Hvad kan ændre et fast stofs opløselighed i væske?
- Temperatur:Generelt stiger opløseligheden af de fleste faste stoffer med temperaturen. Når temperaturen stiger, stiger den kinetiske energi af opløsningsmiddelmolekylerne, hvilket gør det muligt for dem at bryde flere opløste partikler fra hinanden og opløse dem. Nogle stoffer udviser dog retrograd opløselighed, hvor deres opløselighed falder med stigende temperatur.
- Tryk:For faste stoffer, der opløses ved dannelse af gasser (f.eks. natriumbicarbonat i vand), kan stigende tryk øge opløseligheden. Dette skyldes, at øget tryk begunstiger opløsningen af gasser.
- Opløsningsmiddelsammensætning:Opløsningsmidlets beskaffenhed og sammensætning kan i væsentlig grad påvirke opløseligheden af et fast stof. For eksempel øger tilsætning af salt (natriumchlorid) til vand opløseligheden af polære opløste stoffer som sukker, men mindsker opløseligheden af ikke-polære opløste stoffer som olie.
- pH:For sure eller basiske faste stoffer kan opløsningsmidlets pH påvirke opløseligheden. Ændringer i pH kan ændre det opløste stofs ioniseringstilstand og ændre dets opløselighed.
- Kompleksdannelse:Tilstedeværelsen af kompleksdannende midler (ligander) i opløsningsmidlet kan danne komplekser med det opløste stof, hvilket ændrer dets opløselighed. For eksempel kan ammoniak øge opløseligheden af metalhydroxider ved at danne opløselige komplekser.
- Tilsætning af andre opløste stoffer:Tilsætning af et andet opløst stof til opløsningsmidlet kan konkurrere med det faste stof om solvatisering, enten øge eller mindske dets opløselighed. Dette fænomen er kendt som den almindelige ioneffekt.
 Varme artikler
Varme artikler
-
 Video:Chemistry life hacks:MadudgaveKredit:The American Chemical Society Reactions er tilbage med endnu en omgang kemi life hacks. Vores seneste afsnit bringer kemi til køkkenet, og indeholder videnskabsstøttede tips til at tilbere
Video:Chemistry life hacks:MadudgaveKredit:The American Chemical Society Reactions er tilbage med endnu en omgang kemi life hacks. Vores seneste afsnit bringer kemi til køkkenet, og indeholder videnskabsstøttede tips til at tilbere -
 Fysikere kaster røntgenlys på smeltende polymererIllustration. Undvigende polymerer. Kredit:@Lion_on_helium/MIPT Fysikere fra Moscow Institute of Physics and Technology (MIPT) og Lomonosov Moscow State University har kombineret termisk analyse o
Fysikere kaster røntgenlys på smeltende polymererIllustration. Undvigende polymerer. Kredit:@Lion_on_helium/MIPT Fysikere fra Moscow Institute of Physics and Technology (MIPT) og Lomonosov Moscow State University har kombineret termisk analyse o -
 Ny, holdbar katalysator til nøglebrændstofcellereaktion kan vise sig nyttig i miljøvenlige køret…En faktor, der holder den udbredte brug af miljøvenlige brintbrændselsceller tilbage i biler, lastbiler og andre køretøjer er prisen for de platinkatalysatorer, der får cellerne til at fungere. En til
Ny, holdbar katalysator til nøglebrændstofcellereaktion kan vise sig nyttig i miljøvenlige køret…En faktor, der holder den udbredte brug af miljøvenlige brintbrændselsceller tilbage i biler, lastbiler og andre køretøjer er prisen for de platinkatalysatorer, der får cellerne til at fungere. En til -
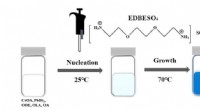 En ny strategi til at skabe blåt lys fra et lovende materialeSkemaet for syntesen af EDBESO4 behandlet CsPbBr3 NPLer. Kredit:Avancerede energimaterialer DOI:10.1002/aenm.202201605 Et forskningshold fra Florida State University har udviklet en ny måde at sk
En ny strategi til at skabe blåt lys fra et lovende materialeSkemaet for syntesen af EDBESO4 behandlet CsPbBr3 NPLer. Kredit:Avancerede energimaterialer DOI:10.1002/aenm.202201605 Et forskningshold fra Florida State University har udviklet en ny måde at sk
- Skadevurdering med hurtig respons giver ny indsigt i den seneste Kansas-tornado
- NASA får et sidste kig på resterne af den tropiske depression Beatriz i Golfen
- Forskere syntetiserer vedvarende olier til brug i smøremidler
- Grimme projektioner for havet - og livet i det
- Hvordan reflektion over taknemmelighed modtaget fra familien kan gøre dig til en bedre leder
- Hvad er der i centrum på CES tech show? Din stemme


