Hvad viser balancerede kemiske ligninger?
1. Bevarelse af masse: Den samlede masse af produkterne i en kemisk reaktion er lig med den samlede masse af reaktanterne. Dette skyldes, at stof ikke kan skabes eller ødelægges i en kemisk reaktion.
2. Bevarelse af energi: Den samlede energi af produkterne i en kemisk reaktion er lig med den samlede energi af reaktanterne. Dette skyldes, at energi ikke kan skabes eller ødelægges i en kemisk reaktion.
3. Stykiometri: Støkiometrien af en kemisk reaktion refererer til det kvantitative forhold mellem reaktanterne og produkterne. Afbalancerede kemiske ligninger giver os mulighed for at bestemme støkiometrien af en reaktion, hvilket er vigtigt for at forstå reaktionen og lave forudsigelser om mængden af involverede reaktanter og produkter.
Overvej for eksempel følgende afbalancerede kemiske ligning:
$$2H_2 + O_2 → 2H_2O$$
Denne ligning viser, at to molekyler af hydrogengas reagerer med et molekyle iltgas for at producere to molekyler vand. Støkiometrien af denne reaktion er 2:1:2, hvilket betyder, at for hver to molekyler brintgas, der reagerer, reagerer et molekyle iltgas, og der produceres to molekyler vand.
 Varme artikler
Varme artikler
-
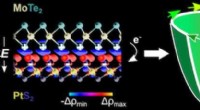 Teori kunne fremskynde skub for spintroniske enhederbilledet til venstre viser krystalstrukturen af et MoTe2|PtS2 heterobillag med isocharge plots fra en model skabt på Rice University. Når materialerne stables sammen, spejlsymmetri er brudt, og der
Teori kunne fremskynde skub for spintroniske enhederbilledet til venstre viser krystalstrukturen af et MoTe2|PtS2 heterobillag med isocharge plots fra en model skabt på Rice University. Når materialerne stables sammen, spejlsymmetri er brudt, og der -
 Forskere gør et betydeligt gennembrud på vej mod det nye superbug-dræbende antibiotikum teixobact…Methicillin-resistent Staphylococcus aureus . Kredit:NIH/NIAID Forskere, der arbejder på at udvikle et game-changing nyt antibiotikum, har gjort et betydeligt fremskridt i retning af at skabe ko
Forskere gør et betydeligt gennembrud på vej mod det nye superbug-dræbende antibiotikum teixobact…Methicillin-resistent Staphylococcus aureus . Kredit:NIH/NIAID Forskere, der arbejder på at udvikle et game-changing nyt antibiotikum, har gjort et betydeligt fremskridt i retning af at skabe ko -
 Nyt tekstil kan holde dig kølig i varmen, varm i kuldenEn mikrostruktureret fiber (til venstre) indeholder porer (til højre), der kan fyldes med et faseskiftende materiale, der absorberer og frigiver termisk energi. Kredit: ACS anvendte materialer og græn
Nyt tekstil kan holde dig kølig i varmen, varm i kuldenEn mikrostruktureret fiber (til venstre) indeholder porer (til højre), der kan fyldes med et faseskiftende materiale, der absorberer og frigiver termisk energi. Kredit: ACS anvendte materialer og græn -
 Nyt værktøj til krystallisation af proteinerKunstnerisk fremstilling af en membran med indlejrede proteiner:ETH Zürich -forskere har udviklet en metode, der vil sætte skub i den strukturelle belysning af sådanne molekyler. Kredit:www.colourbox.
Nyt værktøj til krystallisation af proteinerKunstnerisk fremstilling af en membran med indlejrede proteiner:ETH Zürich -forskere har udviklet en metode, der vil sætte skub i den strukturelle belysning af sådanne molekyler. Kredit:www.colourbox.
- Fysiker diskuterer eRosita-mission
- Forskning undersøger intern kinematik i galaksen Mkn 938
- Sådan løser du Indiens brændende problem – forvandl uønsket halm til bioenergi-piller
- Løj din folkeskolelærer for dig om farve?
- Oprettelse af 2D-nanoark, hvor molekylerne i lagene kun holdes sammen af svage ikke-kovalente bind…
- Hvilken af følgende beskriver bedst en genotype?


