Nyt værktøj til krystallisation af proteiner

Kunstnerisk fremstilling af en membran med indlejrede proteiner:ETH Zürich -forskere har udviklet en metode, der vil sætte skub i den strukturelle belysning af sådanne molekyler. Kredit:www.colourbox.com
ETH -forskere har udviklet en ny metode til krystallisering af store membranproteiner for at bestemme deres struktur. Dette vil være til gavn for biologisk forskning og medicinalindustrien.
Membranindlejrede proteiner er en væsentlig del af celler og enhver form for liv. De findes ikke kun i mange forskellige varianter, men også udføre en lang række funktioner, lige fra intracellulær kommunikation og transport af stoffer ind i eller ud af cellen til formidling af immunresponset. Membranproteiner betragtes som vigtige terapeutiske og diagnostiske målstrukturer. Hvis deres struktur og funktioner kendes, farmaceutiske forskere kan udvikle aktive stoffer, der påvirker disse funktioner målrettet.
Indtil nu, imidlertid, at belyse strukturen af membranproteiner har været meget vanskelig, da det først kræver, at forskere isolerer et stort antal af disse molekyler og danner krystaller fra dem. Deri ligger vanskeligheden:membranproteiner er uopløselige i vand og ofte for store og heterogene til at krystalliseres ved hjælp af standardmetoderne.
Nu, gruppen ledet af Raffaele Mezzenga, Professor i fødevarer og bløde materialer ved ETH Zürich, arbejder på at fjerne denne begrænsning. I en publikation i tidsskriftet Naturkommunikation , gruppen præsenterer en generel metode, som kan bruges til at krystallisere membranproteiner af enhver type eller størrelse.
Lipid-vand-blanding som reaktionskammer
Grundlaget for den nye metode blev lagt i 1990'erne med metoden kaldet "i mesokrystallisering":proteinerne isoleres og koncentreres ved hjælp af stabile vand-lipidblandinger kendt som lipidiske mesofaser. I mesofaser af denne art, en selvsamlingsproces fører til et tredimensionelt netværk af bøjede vandkanaler, hvis vægge består af lipider, som i en biomembran. Disse vandkanaler har typisk en diameter på 3-4 nanometer, og netværkets grundlæggende kubiske motiv gentages med jævne mellemrum.
I kanaler af denne art, membranproteinerne indlejrer sig i væggene ved hjælp af den hydrofobe del, der ellers sidder i cellemembranen. Resten af proteinet ender i vandkanalens indre, og proteiner, en gang korrekt rekonstitueret, kan derefter begynde at krystallisere. Det er netop fordi kanalerne tilbyder så lidt plads, at der tidligere kun små membranproteiner kunne krystalliseres - store proteiner blev knust ud og dannede ikke krystaller.
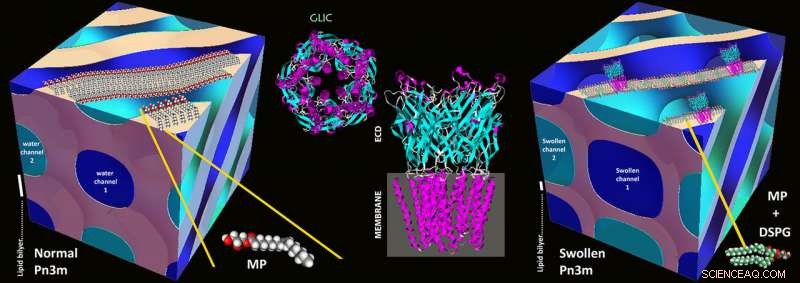
Skematiske illustrationer af en normal Pn3m kubisk mesofase sammensat af MP:vand (til venstre), GLIC -proteinstruktur (midten), og i mesokrystallisering af GLIC -protein i en stærkt hævet Pn3m kubisk mesofase sammensat af DSPG:MP:vand (til højre). Kredit:Zabara A et al., Nat. Komm., 2018
Kanaler udvidet ved hjælp af ladede lipider
ETH -forskerne har nu brugt et trick til at udvide kanalerne:de blandede en lille andel elektrisk ladede lipider med lipiderne. Disse afviser hinanden og puster dermed kanalerne op, øge deres diameter til 20 nanometer. Selvom de første forsøg på elektrostatisk opsvulmning af vandkanaler i lipidmesofaser dateres tilbage til begyndelsen af 2000'erne og er fortsat støt indtil for nylig, dette er den første demonstrerede udvikling af denne strategi til en metode af generel betydning.
Takket være disse hævede lipidiske mesofaser, Ja, Mezzenga og hans kolleger formåede at krystallisere store membranproteiner og derefter belyse deres struktur.
ETH-forskerne praktiserede på membranproteinet kaldet GLIC (Gloeobacter ligand-gated-ion-kanal), som kommer fra bakterier. GLIC har flere store underenheder, der ligger uden for bakteriemembranen i den ydre del af cellen. I fortiden, en anden metode blev brugt til at krystallisere dette kompleks, da disse domæner var for store. "Vores procedure forbedrede ikke kun krystallisationen, men producerede også ekstremt kompakte krystaller tilhørende en ny krystallografisk gruppe for dette protein, "siger Mezzenga. Desuden er forskerne var i stand til at krystallisere dette kanalprotein i sin lukkede konfiguration for første gang. Indtil nu, forskere var i stand til at krystallisere komplekset kun i dets åbne tilstand ved hjælp af en anden metode.
Boost forventes til strukturel belysning
Den nye "generaliseret i meso" -metode vil sandsynligvis have stor interesse for især strukturbiologer, der indtil nu har kæmpet for at belyse strukturen af store membranproteiner. "Dette værktøj vil give ny fremdrift til strukturel belysning, da det åbner proteiner, der tidligere var uden for rækkevidde, ”siger Mezzenga.
På nuværende tidspunkt, forskere kender den nøjagtige struktur af kun 360 små membranproteiner, eller omkring en syvende af alle membranproteiner. Strukturen af de mange resterende membranproteiner er ukendt.
Ifølge Mezzenga, forskningen kan også være til gavn for medicinalindustrien. "Evnen til at bestemme strukturen er af afgørende betydning for udviklingen af nye lægemidler, "siger han." Denne metode vil gøre det betydeligt lettere og give nyt skub i feltet. "
 Varme artikler
Varme artikler
-
 Forskere forudser nye superhårde materialerKredit:Pixabay/CC0 Public Domain En gruppe Skoltech -forskere brugte machine learning (ML) metoder til at forudsige superhårde materialer baseret på deres krystalstruktur. Forskningen blev offent
Forskere forudser nye superhårde materialerKredit:Pixabay/CC0 Public Domain En gruppe Skoltech -forskere brugte machine learning (ML) metoder til at forudsige superhårde materialer baseret på deres krystalstruktur. Forskningen blev offent -
 Ferroelektriske polymerer gjort mere alsidigeEn blokcopolymer af PVDF (sort) og en isolerende polymerkæde (blå) danner en blokcopolymer. Gennem faseadskillelse, blokkene samles i film. De dielektriske egenskaber kan indstilles ved at variere sam
Ferroelektriske polymerer gjort mere alsidigeEn blokcopolymer af PVDF (sort) og en isolerende polymerkæde (blå) danner en blokcopolymer. Gennem faseadskillelse, blokkene samles i film. De dielektriske egenskaber kan indstilles ved at variere sam -
 Ny kemimetode forenkler sen fase-modifikation af lægemiddelforbindelserJin-Quan Yu, Ph.d., Frank og Bertha Hupp Professor i Institut for Kemi på TSRI. Kredit:Scripps Research Institute Kemikere ved The Scripps Research Institute (TSRI) har opfundet en teknik, der ove
Ny kemimetode forenkler sen fase-modifikation af lægemiddelforbindelserJin-Quan Yu, Ph.d., Frank og Bertha Hupp Professor i Institut for Kemi på TSRI. Kredit:Scripps Research Institute Kemikere ved The Scripps Research Institute (TSRI) har opfundet en teknik, der ove -
 Angriber tumorer direkte ved identifikationKredit:CC0 Public Domain Teranostik, kombinationen af terapi og diagnostik, henviser til lægemidler, der ikke kun bruges til at behandle tumorer, men også til at gøre dem synlige. Princippet er
Angriber tumorer direkte ved identifikationKredit:CC0 Public Domain Teranostik, kombinationen af terapi og diagnostik, henviser til lægemidler, der ikke kun bruges til at behandle tumorer, men også til at gøre dem synlige. Princippet er
- Kunne flagermus guide mennesker til rent drikkevand på steder, hvor det er knapt?
- Hvordan bærbare centrifugalolierensesystemer fungerer
- Afstande af planeterne fra solen i lysårene
- Lægemidler og andre forurenende stoffer tvinger fisk til at arbejde meget hårdere for at overleve
- Forskere ved SLACs synkrotron observerer vejrtrækningslag under batteridrift
- Sådan laver egern Food


