Almindelige stoffer, der danner ioniske forbindelser?
Ioniske forbindelser er sammensat af positivt ladede ioner (kationer) og negativt ladede ioner (anioner). Kationer dannes, når metalatomer mister elektroner, mens anioner dannes, når ikke-metalatomer får elektroner.
De mest almindelige metaller, der danner ioniske forbindelser, er alkalimetallerne (gruppe 1) og jordalkalimetallerne (gruppe 2). Disse metaller er meget reaktive og mister let elektroner.
De mest almindelige ikke-metaller, der danner ioniske forbindelser, er halogenerne (Gruppe 17) og kalkogenerne (Gruppe 16). Disse ikke-metaller er også meget reaktive og får let elektroner.
Eksempler på ioniske forbindelser
Her er nogle eksempler på ioniske forbindelser:
- Natriumchlorid (NaCl) er sammensat af natriumioner (Na+) og chloridioner (Cl-).
- Kaliumiodid (KI) er sammensat af kaliumioner (K+) og iodidioner (I-).
- Calciumoxid (CaO) er sammensat af calciumioner (Ca2+) og oxidioner (O2-).
- Magnesiumsulfat (MgSO4) er sammensat af magnesiumioner (Mg2+) og sulfationer (SO42-).
Ioniske forbindelser er essentielle for mange biologiske processer. For eksempel er natrium- og kaliumioner involveret i reguleringen af væskebalancen og nerveimpulser. Calciumioner er involveret i dannelsen af knogler og tænder. Magnesiumioner er involveret i syntesen af proteiner og nukleinsyrer.
Sidste artikelHvad er de to hovedtyper af forbindelser?
Næste artikelHvorfor er natriumhydroxid en stærkere base end ammoniak?
 Varme artikler
Varme artikler
-
 En ny proces til genanvendelse af metallurgisk slaggeKredit:CC0 Public Domain Forskere ved Ural Federal University (UrFU) og Institut for Metallurgi i Ural-afdelingen af Det Russiske Videnskabsakademi (UrB RAS) har udviklet og med succes testet te
En ny proces til genanvendelse af metallurgisk slaggeKredit:CC0 Public Domain Forskere ved Ural Federal University (UrFU) og Institut for Metallurgi i Ural-afdelingen af Det Russiske Videnskabsakademi (UrB RAS) har udviklet og med succes testet te -
 Tværfagligt team designer gasflowcelle til at analysere katalytisk adfærdMed hjælp fra andre forskere fra ORNL og Colorado State University, Daniel Olds og Katharine Page udviklede en gasstrømscelle med U-rør til at studere katalysatorer og bedre forstå, hvordan de letter
Tværfagligt team designer gasflowcelle til at analysere katalytisk adfærdMed hjælp fra andre forskere fra ORNL og Colorado State University, Daniel Olds og Katharine Page udviklede en gasstrømscelle med U-rør til at studere katalysatorer og bedre forstå, hvordan de letter -
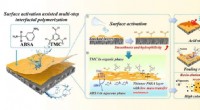 Nye syrefaste membraner til spildevandsrensning udvikletSkematisk mekanisme til fremstilling af syrefast nanofiltreringsmembran og dens overlegne separationsydelse. Kredit:CAO Yang En forskergruppe ledet af prof. Wan Yinhua fra Institute of Process Eng
Nye syrefaste membraner til spildevandsrensning udvikletSkematisk mekanisme til fremstilling af syrefast nanofiltreringsmembran og dens overlegne separationsydelse. Kredit:CAO Yang En forskergruppe ledet af prof. Wan Yinhua fra Institute of Process Eng -
 Træk vejret i stedet for en blodprøveFølsomme måleteknikker gør det muligt at detektere over 800 molekyler involveret i menneskelig metabolisme i en persons udåndinger. Et af disse molekyler er acetone. (Visualiseringer:Güntner et al. J
Træk vejret i stedet for en blodprøveFølsomme måleteknikker gør det muligt at detektere over 800 molekyler involveret i menneskelig metabolisme i en persons udåndinger. Et af disse molekyler er acetone. (Visualiseringer:Güntner et al. J
- En liste over North Carolinas Natural Resources
- Sådan beregnes prøvetagningsfordeling
- Strømforsyning frygter, da tropper kaldes til at bekæmpe skovbrande i Australien (opdatering)
- En ny kvantekontakt til elektronik
- Hvordan producerer du strøm?
- Hvad pokker er det? Forbrugerne kan blive opfordret til at forstå hybridprodukter


