Hvorfor er flydende ammoniak en ikke-elektrolyt, men vandig en elektrolyt?
I modsætning hertil er vandig ammoniak en god elektrolyt. Dette skyldes, at vand også er et polært opløsningsmiddel, men det er mere effektivt til at opløse ioner end flydende ammoniak. Dette betyder, at ionerne i vandig ammoniak er mere tilbøjelige til at bevæge sig frit, hvilket tillader opløsningen at lede elektricitet.
Forskellen i ledningsevnen af flydende ammoniak og vandig ammoniak kan forklares ved forskellen i styrken af hydrogenbindingen mellem opløsningsmiddelmolekylerne. Hydrogenbinding er en type intermolekylær kraft, der opstår, når et brintatom er bundet til et meget elektronegativt atom, såsom nitrogen eller oxygen. I flydende ammoniak er hydrogenbindingen mellem ammoniakmolekylerne stærkere end hydrogenbindingen mellem ammoniakmolekylerne og ionerne. Det betyder, at ionerne er stærkere solvatiseret i flydende ammoniak og derfor er mindre tilbøjelige til at bevæge sig frit.
I modsætning hertil er hydrogenbindingen mellem vandmolekylerne i vandig ammoniak svagere end hydrogenbindingen mellem vandmolekylerne og ionerne. Det betyder, at ionerne er svagere solvatiseret i vandig ammoniak og derfor er mere tilbøjelige til at bevæge sig frit.
Forskellen i styrken af hydrogenbindingen mellem opløsningsmiddelmolekylerne forklarer også forskellen i kogepunkterne for flydende ammoniak og vandig ammoniak. Flydende ammoniak har et kogepunkt på -33,4 °C, mens vandig ammoniak har et kogepunkt på 100 °C. Den stærkere hydrogenbinding mellem ammoniakmolekylerne i flydende ammoniak betyder, at der skal mere energi til for at bryde bindingerne og fordampe væsken.
Sidste artikelHvad er ledningsevnen af ammoniak?
Næste artikelHvad kalder du forfaldne stoffer?
 Varme artikler
Varme artikler
-
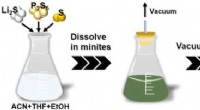 Udvikling af en ny storstilet fremstillingsteknologi til faste sulfidelektrolytterSkema af den nye løsningsbehandlingsteknologi for sulfid SEer. Kredit:Toyohashi University of Technology En forskergruppe i ph.d.-programmet ved Toyohashi University of Technologys afdeling for ele
Udvikling af en ny storstilet fremstillingsteknologi til faste sulfidelektrolytterSkema af den nye løsningsbehandlingsteknologi for sulfid SEer. Kredit:Toyohashi University of Technology En forskergruppe i ph.d.-programmet ved Toyohashi University of Technologys afdeling for ele -
 Forskere udvikler unikt glødende proteinKredit:MIPT Biofysikere fra Moskva Institut for Fysik og Teknologi er gået sammen med kolleger fra Frankrig og Tyskland for at skabe et nyt fluorescerende protein. Udover at gløde, når det bestrål
Forskere udvikler unikt glødende proteinKredit:MIPT Biofysikere fra Moskva Institut for Fysik og Teknologi er gået sammen med kolleger fra Frankrig og Tyskland for at skabe et nyt fluorescerende protein. Udover at gløde, når det bestrål -
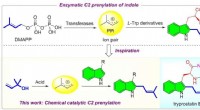 Bioinspireret syrekatalyseret C2-prenylering af indolderivaterBiomimetisk katalyse er et nyt begreb, der efterligner nøglefunktioner i enzymatisk proces. Prenylering er en allestedsnærværende proces, der findes i næsten alle levende organismer. Inspireret af den
Bioinspireret syrekatalyseret C2-prenylering af indolderivaterBiomimetisk katalyse er et nyt begreb, der efterligner nøglefunktioner i enzymatisk proces. Prenylering er en allestedsnærværende proces, der findes i næsten alle levende organismer. Inspireret af den -
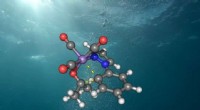 Det nye grønne alternativ til medicinproduktionStruktur af den aktive mangankatalysator i vand. Kredit:Universitetet i Göttingen De fleste af processerne til fremstilling af lægemidler, pesticider og smartphone-skærme er omkostningstunge og ge
Det nye grønne alternativ til medicinproduktionStruktur af den aktive mangankatalysator i vand. Kredit:Universitetet i Göttingen De fleste af processerne til fremstilling af lægemidler, pesticider og smartphone-skærme er omkostningstunge og ge
- MakerLab bliver et knudepunkt for 3D-trykte skalimplantater til skadede kæledyr
- Social identitet inden for anti-vaccinebevægelsen
- Sådan konverteres KWh et år til KW
- Nye matematiske værktøjer til at studere meningsdynamik
- Beregning af en milliard plasmapartikler i en supercomputer
- Intel introducerer kryogen kontrolchip Horse Ridge for at muliggøre styring af flere kvantebits


