Hvilken af følgende ydre elektronkonfigurationer ville du forvente at skulle tilhøre et reaktivt metal?
Her er de ydre elektronkonfigurationer af nogle almindelige elementer og deres reaktivitet:
Helium (He):1s² (ædelgas, ikke-reaktiv)
Lithium (Li):2s¹ (alkalimetal, meget reaktivt)
Natrium (Na):3s¹ (alkalimetal, meget reaktivt)
Magnesium (Mg):3s² (jordalkalimetal, moderat reaktivt)
Aluminium (Al):3s²3p¹ (post-transition metal, mindre reaktivt)
Jern (Fe):3d⁶4s² (overgangsmetal, moderat reaktivt)
Kobber (Cu):3d¹⁰4s¹ (overgangsmetal, mindre reaktivt)
Brom (Br):4s²4p⁵ (halogen, meget reaktivt)
Jod (I):5s²5p⁵ (halogen, moderat reaktiv)
Xenon (Xe):5s²5p⁶ (ædelgas, ikke-reaktiv)
Baseret på dette er den ydre elektronkonfiguration, der forventes at tilhøre et reaktivt metal:
A) ns¹ (én elektron i den yderste skal), som Lithium (Li) eller Natrium (Na).
 Varme artikler
Varme artikler
-
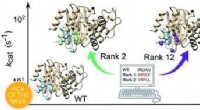 Gamle enzymer kan bidrage til grønnere kemiKredit: Kemisk Videnskab (2020). DOI:10.1039/D0SC01935F Et forskerhold ved Uppsala Universitet har genoplivet flere milliarder år gamle enzymer og omprogrammeret dem til at katalysere helt andre
Gamle enzymer kan bidrage til grønnere kemiKredit: Kemisk Videnskab (2020). DOI:10.1039/D0SC01935F Et forskerhold ved Uppsala Universitet har genoplivet flere milliarder år gamle enzymer og omprogrammeret dem til at katalysere helt andre -
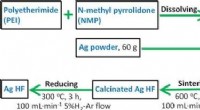 Forskere foreslår en ny metode til at forbedre den elektrokatalytiske omdannelse af kuldioxidDiagram over de detaljerede fremstillingsprocedurer for Ag HF. Kredit:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202210432 Et forskerhold ledet af Profs. Chen Wei og Wei Wei f
Forskere foreslår en ny metode til at forbedre den elektrokatalytiske omdannelse af kuldioxidDiagram over de detaljerede fremstillingsprocedurer for Ag HF. Kredit:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202210432 Et forskerhold ledet af Profs. Chen Wei og Wei Wei f -
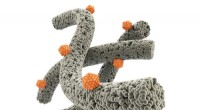 Nanosensorer forbedrer påvisning af sygdomsbiomarkører i udåndet åndeKAIST-forskere designede nanofibre (grå) med proteinindkapslede katalysatorer (orange) for at øge følsomheden og selektiviteten af åndedrætssensorer til sygdomsdetektion. Kredit:KAIST Forskere f
Nanosensorer forbedrer påvisning af sygdomsbiomarkører i udåndet åndeKAIST-forskere designede nanofibre (grå) med proteinindkapslede katalysatorer (orange) for at øge følsomheden og selektiviteten af åndedrætssensorer til sygdomsdetektion. Kredit:KAIST Forskere f -
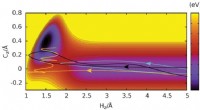 Forskere finder, at H-C-bindinger dannes, når brintatomer kolliderer med grafen med høj hastighedRehybridisering i dannelsen af en C-H-binding ved kollisioner af et H-atom på en grafenoverflade. HZ og CZ er afstandene mellem H- og C -atomerne fra grafenplanet. Tre baner er vist for H-atomer med
Forskere finder, at H-C-bindinger dannes, når brintatomer kolliderer med grafen med høj hastighedRehybridisering i dannelsen af en C-H-binding ved kollisioner af et H-atom på en grafenoverflade. HZ og CZ er afstandene mellem H- og C -atomerne fra grafenplanet. Tre baner er vist for H-atomer med
- Usædvanlige oversvømmelser i det østlige Congo forårsager nød for næsten en halv million menne…
- Hvordan finder man ud af koncentrationen af en farvet opløsning uden titrering eller kolorimetri?…
- Hvad er kilden til energi, der driver vind og strømmende vand?
- Lærere arret af arven fra 1988 anti-LGBT+ lov
- Kanel kan erstatte skadelige kemikalier, der bruges til at skabe nanopartikler
- Strømforsyning:Forståelse af ustabile net


