Hvad sker der, når magnesium reagerer med saltsyre?
Mg (s) + 2 HCl (aq) → MgCl2 (aq) + H2 (g)
Forklaring:
Magnesium er et relativt reaktivt metal, hvilket betyder, at det let taber elektroner til andre atomer eller molekyler. Saltsyre er en stærk syre, der dissocierer i vand og danner hydrogenioner (H+) og chloridioner (Cl-).
Når magnesium kommer i kontakt med saltsyre, mister magnesiumatomerne to elektroner hver og bliver til positivt ladede magnesiumioner (Mg2+). Disse magnesiumioner tiltrækkes derefter af de negativt ladede chloridioner, danner en ionbinding og danner magnesiumchlorid (MgCl2).
Samtidig reagerer hydrogenionerne fra saltsyren med elektronerne tabt af magnesiumatomerne og danner brintgas (H2). Brintgassen frigives som en farveløs, lugtfri gas, der bobler ud af opløsningen.
Den overordnede reaktion er eksoterm, hvilket betyder, at der frigives varme, efterhånden som produkterne dannes. Dette kan observeres som en let stigning i reaktionsblandingens temperatur.
Denne reaktion er et klassisk eksempel på en enkelt-erstatningsreaktion, hvor et grundstof (magnesium) erstatter et andet grundstof (brint) i en forbindelse (saltsyre).
 Varme artikler
Varme artikler
-
 100 procent biobaseret, gennemsigtig, og termisk stabil polyamidFra træaffald til højtydende polymerer:Terpener fra terpentin omdannes til biobaserede, gennemsigtige og varmestabile polyamider under påføring af en ny katalytisk proces. Kredit:Fraunhofer IGB De
100 procent biobaseret, gennemsigtig, og termisk stabil polyamidFra træaffald til højtydende polymerer:Terpener fra terpentin omdannes til biobaserede, gennemsigtige og varmestabile polyamider under påføring af en ny katalytisk proces. Kredit:Fraunhofer IGB De -
 Kollagen nanofibriller i pattedyrs væv bliver stærkere med træningEn kollagenfibril monteret på en MEMS mekanisk testanordning. Nederst er et enkelt menneskehår til størrelsessammenligning. Kredit:University of Illinois Department of Aerospace Engineering Kollag
Kollagen nanofibriller i pattedyrs væv bliver stærkere med træningEn kollagenfibril monteret på en MEMS mekanisk testanordning. Nederst er et enkelt menneskehår til størrelsessammenligning. Kredit:University of Illinois Department of Aerospace Engineering Kollag -
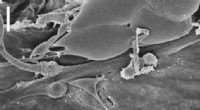 Molekylær volumenkontrolLarven Drosophila chordotonal organ set under scanningselektronmikroskopet. Denne sensoriske funktionelle enhed modulerer behandlingen af mekaniske stimuli ved hjælp af latrophilinreceptoren. Målest
Molekylær volumenkontrolLarven Drosophila chordotonal organ set under scanningselektronmikroskopet. Denne sensoriske funktionelle enhed modulerer behandlingen af mekaniske stimuli ved hjælp af latrophilinreceptoren. Målest -
 En ny cermet, der kunne give en bedre varmeudveksling til solenergianlægEn nylig udvikling ville gøre elproduktion fra solens varme mere effektiv, ved at bruge keramiske metalplader til varmeoverførsel ved højere temperaturer og ved forhøjede tryk. Kredit:Purdue Universit
En ny cermet, der kunne give en bedre varmeudveksling til solenergianlægEn nylig udvikling ville gøre elproduktion fra solens varme mere effektiv, ved at bruge keramiske metalplader til varmeoverførsel ved højere temperaturer og ved forhøjede tryk. Kredit:Purdue Universit
- Hvordan man fremstiller brandhæmmende polyethylen
- High-throughput computermodel forudsiger diffusionsdata for transporten af lette elementer i faste…
- Sådan finder du acceleration i Gs
- Kæledyr eller trusler? Guldfisk kan være skadelig for biodiversiteten
- Nanopartikler leverer et-to terapeutiske slag for at dræbe tumorceller
- Hvordan modner ænder?


