Får eller taber helium elektroner for at danne forbindelser?
I næsten alle tilfælde forbliver heliumatomer som individuelle atomer og deltager ikke i kemiske reaktioner. Denne egenskab gør helium til en almindeligt anvendt gas til fyldning af balloner og luftskibe, såvel som til applikationer som kryogenik, højtryksgasbeholdere og partikelacceleratorer.
 Varme artikler
Varme artikler
-
 Brændselscelle fremme et frisk pust til fremtidigt kraftalternativFast oxid brændselsceller kan bruges i en række forskellige applikationer, herunder effektiv generering af primær- eller nødstrømforsyning til bygninger. En gruppe Bloom Energy-servere genererer strøm
Brændselscelle fremme et frisk pust til fremtidigt kraftalternativFast oxid brændselsceller kan bruges i en række forskellige applikationer, herunder effektiv generering af primær- eller nødstrømforsyning til bygninger. En gruppe Bloom Energy-servere genererer strøm -
 Forskere tilfører bakterier med sølv for at forbedre energieffektiviteten i brændselscellerKunstnerens koncept om en mikrobiel brændselscelle med effektivitet boostet af sølv nanopartikler. Kredit:AKang, Sphere Studio. Copyright:Yu Huang og Xiangfeng Duan. AUCLA-ledede team af ingeniøre
Forskere tilfører bakterier med sølv for at forbedre energieffektiviteten i brændselscellerKunstnerens koncept om en mikrobiel brændselscelle med effektivitet boostet af sølv nanopartikler. Kredit:AKang, Sphere Studio. Copyright:Yu Huang og Xiangfeng Duan. AUCLA-ledede team af ingeniøre -
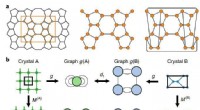 En ny matematisk tilgang til forståelse af zeolitterGraph og supercell matching. en, Repræsentation af en zeolit ved hjælp af en graf (til venstre). Enhedscellegrafen (midten) modificeres for at opfylde periodiske grænsebetingelser ved at sløjfe bind
En ny matematisk tilgang til forståelse af zeolitterGraph og supercell matching. en, Repræsentation af en zeolit ved hjælp af en graf (til venstre). Enhedscellegrafen (midten) modificeres for at opfylde periodiske grænsebetingelser ved at sløjfe bind -
 Forskerhold udvikler materiale til at adskille olie og vand til miljøsanering og spildevandsrensnin…Filtrering er en enkel, energieffektiv vandbehandlingsmetode, og kan være en effektiv måde at rydde op i olieudslip, ” sagde Ayse Asatekin. Her, et billede af den nye fibermembran, der viser dens tilf
Forskerhold udvikler materiale til at adskille olie og vand til miljøsanering og spildevandsrensnin…Filtrering er en enkel, energieffektiv vandbehandlingsmetode, og kan være en effektiv måde at rydde op i olieudslip, ” sagde Ayse Asatekin. Her, et billede af den nye fibermembran, der viser dens tilf
- Avanceret billeddannelse afslører usædvanligt, usynlige mønstre i havfuglefjer
- Forskere opdager optimale betingelser for masseproduktion af ultraviolette hologrammer
- Nyt spin på grafen
- Fuld udnyttelse af supercomputeres potentiale
- Kan du give mig en sætning med ordet cellemembran?
- Sådan Find Recombinant Afkom


