Påvirker tilsætning af vand pH-værdien af en sur opløsning?
En opløsnings pH er et mål for dens surhedsgrad eller basicitet. Det bestemmes af koncentrationen af hydrogenioner (H+) i opløsningen. Sure opløsninger har en høj koncentration af H+ ioner, mens basiske opløsninger har en lav koncentration af H+ ioner.
Når vand tilsættes til en sur opløsning, brydes vandmolekylerne i H+ ioner og hydroxidioner (OH-). H+ ionerne fra vandet kombineres med anionerne (negative ioner) i den sure opløsning, hvilket reducerer koncentrationen af H+ ioner i opløsningen. Dette resulterer i et fald i opløsningens pH, hvilket gør den mindre sur.
Overvej f.eks. en sur opløsning, der indeholder saltsyre (HCl). Når vand tilsættes til denne opløsning, brydes vandmolekylerne i H+ og OH- ioner. H+ ionerne fra vandet kombineres med chloridionerne (Cl-) fra HCl og danner hydrogenchlorid (HCl) molekyler. Dette reducerer koncentrationen af H+ ioner i opløsningen, hvilket resulterer i et fald i opløsningens pH.
Samlet set sænker tilsætning af vand til en sur opløsning typisk dens pH, hvilket gør den mindre sur.
 Varme artikler
Varme artikler
-
 Kvantekemi løser mysteriet med de 20 aminosyrer i den genetiske kodeDe første 13 aminosyrer er karakteriseret ved meget ens kemisk hårdhed og elektroniske energiniveauer (vist på billedet som en enkelt cirkel). De nye aminosyrer blev mere og mere blødere og mere indiv
Kvantekemi løser mysteriet med de 20 aminosyrer i den genetiske kodeDe første 13 aminosyrer er karakteriseret ved meget ens kemisk hårdhed og elektroniske energiniveauer (vist på billedet som en enkelt cirkel). De nye aminosyrer blev mere og mere blødere og mere indiv -
 Kunstigt lungekræftvæv kan hjælpe med at finde nye lægemiddelbehandlinger3D -hydrogel oprettet i universitetsprofessor Molly Shochets laboratorium blev modelleret til at efterligne miljøet for lungekræft, muliggøre mere effektiv og hurtigere lægemiddelscreening. Kredit:Rob
Kunstigt lungekræftvæv kan hjælpe med at finde nye lægemiddelbehandlinger3D -hydrogel oprettet i universitetsprofessor Molly Shochets laboratorium blev modelleret til at efterligne miljøet for lungekræft, muliggøre mere effektiv og hurtigere lægemiddelscreening. Kredit:Rob -
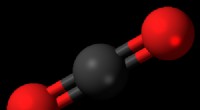 Forsker undersøger, hvordan man konverterer kuldioxid til byggestenene til brændstofBall-and-stick model af kuldioxid. Kredit:Wikipedia At opdele de kemiske bindinger i CO2 molekyler, er der brug for varme. En måde at få denne varme på er fra plasmaer, og det har længe været kendt
Forsker undersøger, hvordan man konverterer kuldioxid til byggestenene til brændstofBall-and-stick model af kuldioxid. Kredit:Wikipedia At opdele de kemiske bindinger i CO2 molekyler, er der brug for varme. En måde at få denne varme på er fra plasmaer, og det har længe været kendt -
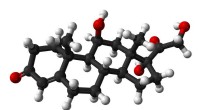 Tegn på udbrændthed kan påvises i svedBold-og-stik-model af cortisol (hydrocortison) molekylet. Kredit:Public Domain EPFL ingeniører, arbejder i samarbejde med startup Xsensio, har udviklet et bærbart system, der løbende kan måle konc
Tegn på udbrændthed kan påvises i svedBold-og-stik-model af cortisol (hydrocortison) molekylet. Kredit:Public Domain EPFL ingeniører, arbejder i samarbejde med startup Xsensio, har udviklet et bærbart system, der løbende kan måle konc
- Almindelig rørlegering kan danne kræftfremkaldende kemikalie i drikkevand
- Hvis du hælder olie i en kop vand, vil giften vande?
- Gør smog til smukke solnedgange?
- Oklahoma er et laboratorium for forskning i menneskeskabte jordskælv
- Er alder forbundet med billedet af den perfekte partner?
- Forskere finder overraskende resultater, når de ser på virkningerne af kulstofnanorør og jordsorp…


