Hvad er oxidationstallet for aluminiumkarbonat?
Aluminium (Al):
I de fleste forbindelser har aluminium et oxidationstal på +3. Det betyder, at den mister tre valenselektroner for at opnå en stabil elektronkonfiguration.
Kulstof (C):
Kulstof kan have forskellige oxidationstal afhængigt af den forbindelse, det danner. I carbonater har carbon typisk et oxidationstal på +4.
Ilt (O):
I de fleste forbindelser har oxygen et oxidationstal på -2. Det betyder, at den får to elektroner for at opnå en stabil elektronkonfiguration.
Lad os nu beregne oxidationstallet for aluminiumcarbonat (Al2(CO3)3):
Aluminium (Al):
Der er to aluminiumsatomer i formlen, og hvert aluminiumatom har et oxidationstal på +3. Så det samlede oxidationstal for aluminium er:
2 (+3) =+6
Kulstof (C):
Der er tre carbonationer (CO3) i formlen, og hver carbonation indeholder et carbonatom. Da oxidationstallet for carbon i carbonat er +4, er det samlede oxidationstal for carbon:
3 (+4) =+12
Ilt (O):
Der er i alt 9 oxygenatomer i de tre carbonationer. Hvert oxygenatom har et oxidationstal på -2. Så det samlede oxidationstal for oxygen er:
9 (-2) =-18
Lad os nu lægge oxidationstallene sammen for alle grundstofferne i forbindelsen:
Totalt oxidationstal =(+6) + (+12) + (-18) =0
Da det samlede oxidationstal for aluminiumcarbonat er 0, er det en neutral forbindelse. Med andre ord balancerer de positive og negative ladninger hinanden, hvilket resulterer i et elektrisk neutralt molekyle.
Sidste artikelHvad er natriumindholdet i blødgjort vand?
Næste artikelNad plus opfanger elektroner og brintdannelse?
 Varme artikler
Varme artikler
-
 Ny model forudsiger ændringer i træKredit:Universitetet i Borås Træ er et levende materiale, der ændrer sig med varierende temperaturer og luftfugtighed. Sabina Huč, tidligere forsker ved Universitetet i Borås, har udviklet en mode
Ny model forudsiger ændringer i træKredit:Universitetet i Borås Træ er et levende materiale, der ændrer sig med varierende temperaturer og luftfugtighed. Sabina Huč, tidligere forsker ved Universitetet i Borås, har udviklet en mode -
 En opgradering til magnetiske resonansmetoder med en 1.000-fold forstærkerKredit:CC0 Public Domain Forskere bestemmer strukturen og dynamikken af proteiner ved hjælp af NMR (Nuclear Magnetic Resonance) spektroskopi. Indtil nu har det dog været nødvendigt med meget høje
En opgradering til magnetiske resonansmetoder med en 1.000-fold forstærkerKredit:CC0 Public Domain Forskere bestemmer strukturen og dynamikken af proteiner ved hjælp af NMR (Nuclear Magnetic Resonance) spektroskopi. Indtil nu har det dog været nødvendigt med meget høje -
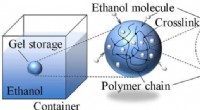 Forskere viser, hvordan man opbevarer flydende brændstoffer i polymere geler for at forhindre ekspl…Forskere fra SIT Japan viste i en ny undersøgelse, at kemisk tværbundne polymere gel-netværk kan fange meget flygtige flydende brændstofmolekyler, såsom ethanol, gennem fysiske interaktioner og derved
Forskere viser, hvordan man opbevarer flydende brændstoffer i polymere geler for at forhindre ekspl…Forskere fra SIT Japan viste i en ny undersøgelse, at kemisk tværbundne polymere gel-netværk kan fange meget flygtige flydende brændstofmolekyler, såsom ethanol, gennem fysiske interaktioner og derved -
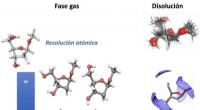 DNA -sukker karakteriseret i en hidtil uset opløsning, atom for atomTil venstre, strukturerne er fuldstændigt isoleret fra ethvert eksternt middel (opløsningsmiddel, krystallinsk bundtning) og til højre, strukturerne i vandet. I den mest rigelige struktur, de faste pr
DNA -sukker karakteriseret i en hidtil uset opløsning, atom for atomTil venstre, strukturerne er fuldstændigt isoleret fra ethvert eksternt middel (opløsningsmiddel, krystallinsk bundtning) og til højre, strukturerne i vandet. I den mest rigelige struktur, de faste pr
- Sollys kan nedbryde havplastik til titusindvis af kemiske forbindelser
- Søger energiuafhængighed, Palæstinensere åbner solcelleanlæg
- Sociale flagermus betaler en pris:Svampesygdom, hvid-næse-syndrom ... udryddelse?
- Europæiske virksomheder siger, at Kinas forretning er sværere
- Sådan identificerer du Cow Killer Ant
- Hvad er hemmeligheden bag lykke?


