Har krypton en krystalgitterstruktur?
I modsætning hertil er elementer, der danner krystalgitterstrukturer, typisk metaller, ioniske forbindelser eller kovalente faste stoffer. I disse stoffer er atomerne, ionerne eller molekylerne arrangeret i et regelmæssigt, gentaget mønster, der danner et krystalgitter. Metaller er karakteriseret ved deres metalliske binding, hvor elektroner delokaliseres og bevæger sig frit inden for gitteret. Ioniske forbindelser er sammensat af positivt ladede ioner (kationer) og negativt ladede ioner (anioner) holdt sammen af elektrostatiske kræfter. Kovalente faste stoffer består af atomer, der er kovalent bundet sammen, og deler elektronpar for at danne et stærkt netværk.
Krypton, som er en ædelgas, mangler de egenskaber, der er nødvendige for at danne en krystalgitterstruktur. Det eksisterer som individuelle atomer, og dets interaktioner med andre atomer er begrænset til svage van der Waals-kræfter. Som et resultat forbliver krypton i en gasformig tilstand under normale forhold og udviser ikke en krystallinsk struktur.
 Varme artikler
Varme artikler
-
 En selvhelbredende, vandafvisende belægning, der er ultra holdbarEn vanddråbe hopper af en hydrofob belægning på en overflade, der er blevet brændt og slidt i NCRC den 28. marts, 2017. Kredit:Joseph Xu/Multimedia Content Producer, University of Michigan - Engineeri
En selvhelbredende, vandafvisende belægning, der er ultra holdbarEn vanddråbe hopper af en hydrofob belægning på en overflade, der er blevet brændt og slidt i NCRC den 28. marts, 2017. Kredit:Joseph Xu/Multimedia Content Producer, University of Michigan - Engineeri -
 Kemikere, der overraskende opdagede nanokonfinerede reaktioner, kunne hjælpe med katalytisk designKredit:Georgia State University Georgia State University kemiforskere har afsløret et af mysterierne bag katalytiske reaktioner i mikroskopisk skala, giver mulighed for design af mere effektive in
Kemikere, der overraskende opdagede nanokonfinerede reaktioner, kunne hjælpe med katalytisk designKredit:Georgia State University Georgia State University kemiforskere har afsløret et af mysterierne bag katalytiske reaktioner i mikroskopisk skala, giver mulighed for design af mere effektive in -
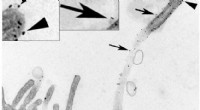 Downstream-signalering:Cilia frigiver ektosomer for at levere vigtige beskeder i nyrenImmunogold mærkning af Exoc5-myc (en komponent i eksocysten) i MDCK-celler viser sorte prikker langs det primære cilium (pilespidser) og tilhørende vesikler (pile). Billedet er taget ved 53, 400X fors
Downstream-signalering:Cilia frigiver ektosomer for at levere vigtige beskeder i nyrenImmunogold mærkning af Exoc5-myc (en komponent i eksocysten) i MDCK-celler viser sorte prikker langs det primære cilium (pilespidser) og tilhørende vesikler (pile). Billedet er taget ved 53, 400X fors -
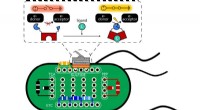 Switch-in-a-celle elektrificerer livetRice University forskere brugte E coli bakterier som en platform til at teste proteinkontakter, der kan bruges til at kontrollere strømmen af elektroner. Proteiner placeret i celler kan simpelthen
Switch-in-a-celle elektrificerer livetRice University forskere brugte E coli bakterier som en platform til at teste proteinkontakter, der kan bruges til at kontrollere strømmen af elektroner. Proteiner placeret i celler kan simpelthen
- Meget forbedrede klimaforudsigelser fra statistisk mekanik
- Seere, der tweeter under præsidentdebatter, lærer mere om politiske spørgsmål
- Hvordan man bliver kvitt mus om vinteren
- At fylde det tidlige univers med knuder kan forklare, hvorfor verden er tredimensionel
- Ny teknik til at studere rustning af stål gavner mineindustrien
- Hvordan europæiske afgørelser bringer flagskibet Google-produkt i fare


