Hvilke kovalente bindinger er mest polære?
Nogle eksempler på meget polære kovalente bindinger omfatter:
- Hydrogen-fluorbinding (H-F)
- Hydrogen-oxygenbinding (H-O)
- Hydrogen-nitrogenbinding (H-N)
- Klor-fluorbinding (Cl-F)
- Brom-fluorbinding (Br-F)
Polariteten af en kovalent binding kan have en betydelig indflydelse på en forbindelses egenskaber. For eksempel kan polære kovalente bindinger bidrage til dannelsen af hydrogenbindinger, som er stærke intermolekylære kræfter, der kan påvirke kogepunktet, smeltepunktet og opløseligheden af en forbindelse.
 Varme artikler
Varme artikler
-
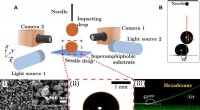 Løft af en siddende dråbe fra en superamfifob overflade ved hjælp af en stødende dråbeEksperimentel tilgang og det fastsiddende fald. (A) Skitse af den eksperimentelle opsætning for binær dråbepåvirkning på superamfifobe overflader. Nålen er fikseret for at indstille stødhøjden i Z-ret
Løft af en siddende dråbe fra en superamfifob overflade ved hjælp af en stødende dråbeEksperimentel tilgang og det fastsiddende fald. (A) Skitse af den eksperimentelle opsætning for binær dråbepåvirkning på superamfifobe overflader. Nålen er fikseret for at indstille stødhøjden i Z-ret -
 Radikalt nyt behandlingssystem lyser op i kræftbehandlingForskere fra Institute of Industrial Science, University of Tokyo har udviklet et strømlinet foto-uncaging-system til fotodynamisk cancerterapi, ved hjælp af en lyspuls til tumorspecifik aktivering af
Radikalt nyt behandlingssystem lyser op i kræftbehandlingForskere fra Institute of Industrial Science, University of Tokyo har udviklet et strømlinet foto-uncaging-system til fotodynamisk cancerterapi, ved hjælp af en lyspuls til tumorspecifik aktivering af -
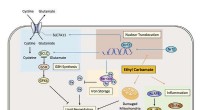 Forskere opdager mekanismen for ethylcarbamat-induceret toksicitet i fermenteret madKredit:Redox Biology Ethylcarbamat (EC) er et farligt stof, der naturligt produceres under gæringen af fødevarer og drikkevarer. Det er blevet kategoriseret som sandsynligvis kræftfremkaldende f
Forskere opdager mekanismen for ethylcarbamat-induceret toksicitet i fermenteret madKredit:Redox Biology Ethylcarbamat (EC) er et farligt stof, der naturligt produceres under gæringen af fødevarer og drikkevarer. Det er blevet kategoriseret som sandsynligvis kræftfremkaldende f -
 Laserteknikker og fotokemi finder en uhåndgribelig molekylær byggestenMolekyle og skema udlånt af Cheng Zhu og Ralf I. Kaiser. Kredit:Gerd Altmann En vigtig molekylær byggesten i fosforkemi har været uhåndgribelig, indtil nu. University of Hawaii at Manoa forskere h
Laserteknikker og fotokemi finder en uhåndgribelig molekylær byggestenMolekyle og skema udlånt af Cheng Zhu og Ralf I. Kaiser. Kredit:Gerd Altmann En vigtig molekylær byggesten i fosforkemi har været uhåndgribelig, indtil nu. University of Hawaii at Manoa forskere h
- Er W et grundstof eller en forbindelse?
- Hvordan filterfodrende toskallede kunne bruges til at rense mikroplastik
- Project Silica proof of concept stores Warner Bros. Superman-film på kvartsglas
- Berømte sorte hul har jetskubber den kosmiske hastighedsgrænse
- Naturbrande udløser evakuering i det nordlige Californien
- Værdien af menneskers værdier:Undersøgelse viser, hvordan relationelle værdier bidrager til bæ…


