Beskriver et molekyle, hvor de positive og negative ladninger er adskilt?
Polære molekyler dannes, når atomerne, der udgør molekylet, har forskellige elektronegativiteter. Elektronegativitet er et mål for et atoms evne til at tiltrække elektroner. Når to atomer med forskellige elektronegativiteter bindes, vil det mere elektronegative atom tiltrække elektronerne stærkere, hvilket skaber en delvis negativ ladning på sig selv og en delvis positiv ladning på det andet atom.
Et molekyles polaritet kan også påvirkes af molekylets form. Et symmetrisk molekyle, såsom kuldioxid, har ikke noget netto dipolmoment, fordi de positive og negative ladninger er jævnt fordelt. Et asymmetrisk molekyle, såsom vand, har dog et netto dipolmoment, fordi de positive og negative ladninger er adskilt.
Polære molekyler er vigtige, fordi de kan interagere med hinanden gennem dipol-dipol-interaktioner. Disse interaktioner er ansvarlige for sammenhængen mellem polære væsker og opløseligheden af polære stoffer i polære opløsningsmidler. Polære molekyler spiller også en vigtig rolle i biologiske systemer, hvor de er involveret i en række forskellige interaktioner, såsom hydrogenbinding og ionbinding.
 Varme artikler
Varme artikler
-
 Bygger næste generations smarte materialer med lydens kraftEn akustisk skabt MOF, med mikrochippen, der producerede de højfrekvente lydbølger, der blev brugt i processen. Kredit:RMIT University Forskere har brugt lydbølger til præcist at manipulere atomer
Bygger næste generations smarte materialer med lydens kraftEn akustisk skabt MOF, med mikrochippen, der producerede de højfrekvente lydbølger, der blev brugt i processen. Kredit:RMIT University Forskere har brugt lydbølger til præcist at manipulere atomer -
 Observation af brinteffekter i metalDenne illustration viser hovedelementerne i det system, holdet brugte:Den flerfarvede plade i midten er det metallag, der studeres, det lyseblå område til venstre er elektrolytopløsningen, der bruges
Observation af brinteffekter i metalDenne illustration viser hovedelementerne i det system, holdet brugte:Den flerfarvede plade i midten er det metallag, der studeres, det lyseblå område til venstre er elektrolytopløsningen, der bruges -
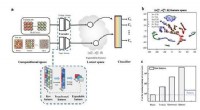 Krystalstruktur forudsigelse af multi-elementer tilfældig legeringKredit:Pohang University of Science &Technology (POSTECH) Alkymi, som forsøgte at gøre billige metaller som bly og kobber til guld, endnu ikke er lykkedes. Imidlertid, med udviklingen af legerin
Krystalstruktur forudsigelse af multi-elementer tilfældig legeringKredit:Pohang University of Science &Technology (POSTECH) Alkymi, som forsøgte at gøre billige metaller som bly og kobber til guld, endnu ikke er lykkedes. Imidlertid, med udviklingen af legerin -
 Metalionkatalysatorer og brintoverilte kan gøre plastproduktionen grønnereIllinois professor David Flaherty, ret, og kandidatstuderende Daniel Bregante arbejder på en grønnere måde at producere plast- og harpiksforstadier, der stammer fra fossile brændstoffer, en proces, de
Metalionkatalysatorer og brintoverilte kan gøre plastproduktionen grønnereIllinois professor David Flaherty, ret, og kandidatstuderende Daniel Bregante arbejder på en grønnere måde at producere plast- og harpiksforstadier, der stammer fra fossile brændstoffer, en proces, de
- Forest Service advarer om budgetnedskæringer forud for en risikabel naturbrandsæson - hvad betyder…
- Hvorfor nogle stemmer lyder mere attraktive
- Et billede taget med en mobiltelefon for at opdage svindel i rismærkning
- Forskere ser defekter i potentiel ny halvleder
- Hvordan adskiller de energityper, der udgør EM-spektrum sig?
- Californien skal piskesave mellem tørke, oversvømmelser:undersøgelse


