Hvorfor er damptrykket af faste stoffer langt mindre end disse væsker?
I modsætning hertil holdes partiklerne i væsker sammen af svagere intermolekylære kræfter, hvilket giver dem mulighed for at bevæge sig mere frit og lettere undslippe overfladen. Derfor har væsker et højere damptryk sammenlignet med faste stoffer.
Et stofs damptryk er direkte relateret til dets temperatur. Når temperaturen stiger, stiger partiklernes kinetiske energi også, hvilket får dem til at bevæge sig hurtigere og lettere overvinde de intermolekylære kræfter. Dette fører til en stigning i damptrykket af både faste stoffer og væsker. Imidlertid stiger damptrykket af væsker hurtigere sammenlignet med faste stoffer med stigende temperatur på grund af de svagere intermolekylære kræfter i væsker.
Sammenfattende resulterer de stærke intermolekylære kræfter i faste stoffer sammenlignet med væsker i et væsentligt lavere damptryk for faste stoffer.
Sidste artikelHvorfor er nogle gasser tungere end andre?
Næste artikelHvad er den kemiske formel for hørfrøolie?
 Varme artikler
Varme artikler
-
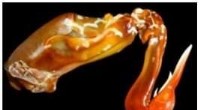 Mantis-rejeklubbens mangefacetterede design er inspirerende avancerede kompositmaterialer til fly, f…Et tværsnit af mantis-rejeklubben viser den stribede region, der var karakteriseret af UCR-forskere. Denne region består af en unik struktur, der vikler sig rundt om køllen for at beskytte den mod sel
Mantis-rejeklubbens mangefacetterede design er inspirerende avancerede kompositmaterialer til fly, f…Et tværsnit af mantis-rejeklubben viser den stribede region, der var karakteriseret af UCR-forskere. Denne region består af en unik struktur, der vikler sig rundt om køllen for at beskytte den mod sel -
 Kemiske jobsøgende står over for hårde udsigter under pandemienKredit:CC0 Public Domain Selvom det er over et årti, recessionen i 2008 og dens virkninger stadig hænger over kemi -virksomheden. Og nu med COVID-19-pandemien, der lukker laboratorier og universit
Kemiske jobsøgende står over for hårde udsigter under pandemienKredit:CC0 Public Domain Selvom det er over et årti, recessionen i 2008 og dens virkninger stadig hænger over kemi -virksomheden. Og nu med COVID-19-pandemien, der lukker laboratorier og universit -
 Afsætning af jernarter inde i ZSM-5 for at oxidere cyclohexan til cyclohexanonKredit:Unsplash/CC0 Public Domain Den direkte katalytiske oxidation af alkaner har høj atomøkonomi og anvendelsesværdi til dannelse af tilsvarende kemiske organiske produkter, såsom alkoholer, ald
Afsætning af jernarter inde i ZSM-5 for at oxidere cyclohexan til cyclohexanonKredit:Unsplash/CC0 Public Domain Den direkte katalytiske oxidation af alkaner har høj atomøkonomi og anvendelsesværdi til dannelse af tilsvarende kemiske organiske produkter, såsom alkoholer, ald -
 Ny produktionsteknik til højtydende polymer kunne give bedre rustningEn ny katalysator fremstillet af legerede nanopartikler af guld og palladium kan producere PBO-polymer, som bruges i kropsrustninger og andre højtydende stoffer. Den nye katalysator producerer PBO, de
Ny produktionsteknik til højtydende polymer kunne give bedre rustningEn ny katalysator fremstillet af legerede nanopartikler af guld og palladium kan producere PBO-polymer, som bruges i kropsrustninger og andre højtydende stoffer. Den nye katalysator producerer PBO, de
- Kan forældres invalideforsikring øge børns økonomiske mobilitet?
- Opdagelse af nye mikroskopiske arter udvider livets træ
- Elektronisk billard i nanoskala kredsløb:Karakterisering af fotoelektroner med kvantepunktskontakte…
- Hvordan understøtter genetik evolution?
- Stjerne sorte huller:Når David poserer som Goliat
- Forskere udforsker nationale sikkerhedsimplikationer af genredigering


