Er denne kemiske ligning korrekte reaktioner ---- produkter?
Overvej følgende reaktion som et eksempel:
2H2 + O2 -> 2H20
I denne ligning reagerer 2 molekyler hydrogengas (H2) med 1 molekyle iltgas (O2) for at producere 2 molekyler vand (H2O). Hvis vi beregner den samlede masse af reaktanterne og produkterne, får vi:
Reaktanter:2(2 g) + 1(32 g) =36 g
Produkter:2(18 g) =36 g
Som du kan se, er den samlede masse af reaktanterne lig med den samlede masse af produkterne, så loven om bevarelse af masse er overholdt, og ligningen er korrekt.
Det er dog vigtigt at bemærke, at en afbalanceret kemisk ligning kun sikrer, at loven om bevarelse af masse følges, men den garanterer ikke, at reaktionen rent faktisk vil finde sted, eller at den vil fortsætte under de specificerede betingelser. Faktorer som reaktionshastigheder, aktiveringsenergi og reaktionsbetingelser spiller også en rolle i at bestemme, om en reaktion vil finde sted.
 Varme artikler
Varme artikler
-
 Del og erobre:Forskere finder nøglen til at skabe bedre medicin med færre bivirkningerChiralt molekyle. Kredit:Palitel og Naaman. I dag, en ny undersøgelse offentliggjort i Videnskab af professorer Yossi Paltiel fra det hebraiske universitet i Jerusalem og Ron Naaman fra Weizmann
Del og erobre:Forskere finder nøglen til at skabe bedre medicin med færre bivirkningerChiralt molekyle. Kredit:Palitel og Naaman. I dag, en ny undersøgelse offentliggjort i Videnskab af professorer Yossi Paltiel fra det hebraiske universitet i Jerusalem og Ron Naaman fra Weizmann -
 En legering, der bevarer sin hukommelse ved høje temperaturerAlexander Paulsen (th.) og Alberto Ferrari har bragt teori og praksis sammen. Kredit:RUB, Marquard Ved hjælp af computersimulering, Alberto Ferrari beregnede et designforslag til en formhukommelse
En legering, der bevarer sin hukommelse ved høje temperaturerAlexander Paulsen (th.) og Alberto Ferrari har bragt teori og praksis sammen. Kredit:RUB, Marquard Ved hjælp af computersimulering, Alberto Ferrari beregnede et designforslag til en formhukommelse -
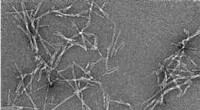 Forstå væksten af sygdomsfremkaldende proteinfibreTransmissionselektronmikrofotografi af fibriller fra proteinet alfa-synuclein, som er forbundet med Parkinsons sygdom. Kredit:University of Bath Amyloidfibriller er aflejringer af proteiner i krop
Forstå væksten af sygdomsfremkaldende proteinfibreTransmissionselektronmikrofotografi af fibriller fra proteinet alfa-synuclein, som er forbundet med Parkinsons sygdom. Kredit:University of Bath Amyloidfibriller er aflejringer af proteiner i krop -
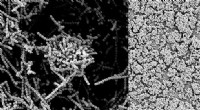 Sukker i modermælk er en ny klasse af antibakterielle midlerNærbilledet til venstre illustrerer, hvordan Strep-bakterier normalt klumper sig sammen for at danne en beskyttende biofilm. Billedet til højre viser, at biofilmen nedbrydes, når en Strep-kultur doser
Sukker i modermælk er en ny klasse af antibakterielle midlerNærbilledet til venstre illustrerer, hvordan Strep-bakterier normalt klumper sig sammen for at danne en beskyttende biofilm. Billedet til højre viser, at biofilmen nedbrydes, når en Strep-kultur doser
- Bedre vejrudsigt gennem satellitisotopdata assimilering
- Brug udtrykkene opløsningsmiddel og opløst stof til at beskrive, hvordan man fremstiller en saltop…
- Forskning viser, hvordan historien kan påvirke succesen og fiaskoen af økologisk genopretning
- NASA ser den tropiske cyklon Debbie gå i land i Queensland
- Rutsjebaneforskning landede, næste flyvning:Månen og Mars
- Video:Hvordan AI og mikroskoper kan hjælpe med at bekæmpe infektion


