Hvad sker der med vand, når calciumchlorid tilsættes vand?
Opløsning: Calciumchlorid er en meget opløselig forbindelse. Når det tilsættes vand, opløses saltet i dets bestanddele:calcium (Ca2+) og chlorid (Cl-). Disse ioner spredes i vandet.
Ioniske interaktioner: Calciumioner (Ca2+) kan interagere med vandmolekyler gennem elektrostatiske kræfter. Vandmolekyler er polære, hvilket betyder, at de har en delvis positiv ladning (nær brintatomerne) og en delvis negativ ladning (nær iltatomet). De positivt ladede calciumioner tiltrækker de negativt ladede oxygenatomer i vandmolekyler og danner en hydreringskugle omkring calciumionerne.
Blødgøring af vand: Calciumchlorid bruges ofte som et blødgøringsmiddel. Hårdt vand indeholder opløste mineraler, såsom calcium- og magnesiumioner, som kan forårsage kalkopbygning i rør og apparater. Når calciumchlorid tilsættes til hårdt vand, reagerer calciumionerne fra saltet med de opløste carbonat- og bikarbonationer i vandet og danner uopløseligt calciumcarbonat (CaCO3), som udfælder ud af opløsningen. Denne proces reducerer koncentrationen af calciumioner i vandet, hvilket gør det blødere.
Koligative egenskaber: Tilsætning af calciumchlorid til vand ændrer dets kolligative egenskaber, såsom kogepunktsforhøjelse og frysepunktssænkning. Kolligative egenskaber afhænger af antallet af partikler opløst i en opløsning, ikke af deres kemiske natur. Ved tilsætning af calciumchlorid øges antallet af partikler i vandet, hvilket fører til en stigning i kogepunktet og et fald i opløsningens frysepunkt.
Overordnet set, når calciumchlorid tilsættes vand, opløses det og dissocieres i dets ioner, interagerer med vandmolekyler gennem elektrostatiske kræfter, kan blødgøre hårdt vand ved at danne uopløseligt calciumcarbonat og ændrer vandets kolligative egenskaber.
Sidste artikelHvilke bjergarter er kobber isoleret fra?
Næste artikelHvorfor skal syrer og baser opbevares sammen?
 Varme artikler
Varme artikler
-
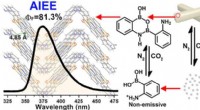 Nyt aggregationsinduceret aromatisk molekyle med forbedret emission opdaget2-APBA-dimeren, der har tendens til at aggregere til en meget ordnet struktur, er AIEE-aktiv. Kredit:LI Xiaopei Aggregations-inducerede molekyler med øget emission (AIEE), nye selvlysende material
Nyt aggregationsinduceret aromatisk molekyle med forbedret emission opdaget2-APBA-dimeren, der har tendens til at aggregere til en meget ordnet struktur, er AIEE-aktiv. Kredit:LI Xiaopei Aggregations-inducerede molekyler med øget emission (AIEE), nye selvlysende material -
 Selvhelbredende omvendt filter åbner døren for mange nye anvendelserSelvhelbredende omvendt filter tillader store partikler igennem, men udelukker mindre partikler og gasser. Kredit:Tak-Sing Wong/Birgitt Boschitsch, Penn State En selvhelbredende membran, der funge
Selvhelbredende omvendt filter åbner døren for mange nye anvendelserSelvhelbredende omvendt filter tillader store partikler igennem, men udelukker mindre partikler og gasser. Kredit:Tak-Sing Wong/Birgitt Boschitsch, Penn State En selvhelbredende membran, der funge -
 Tilbereder et ledende alternativ til kobber med aluminiumAluminium er kun en tredjedel af prisen og vægten af kobber, men det er kun omkring 60% som ledende. Aluminiums relativt lave ledningsevne kan være en begrænsning i nogle virkelige applikationer. Kr
Tilbereder et ledende alternativ til kobber med aluminiumAluminium er kun en tredjedel af prisen og vægten af kobber, men det er kun omkring 60% som ledende. Aluminiums relativt lave ledningsevne kan være en begrænsning i nogle virkelige applikationer. Kr -
 Flere elektroniske materialer åbnede op med nye metal-organiske rammerProfessor Richard Walton, University of Warwick. Kredit:University of Warwick Flere materialer til elektroniske applikationer kunne identificeres, takket være opdagelsen af en ny metal-organisk
Flere elektroniske materialer åbnede op med nye metal-organiske rammerProfessor Richard Walton, University of Warwick. Kredit:University of Warwick Flere materialer til elektroniske applikationer kunne identificeres, takket være opdagelsen af en ny metal-organisk
- Forsker sætter rekord for kvantekemiberegninger
- Uddybende spørgsmål:Hvad er et supersolid?
- Efterskælv rasler den kroatiske hovedstad en dag efter kraftigt jordskælv
- Forudsigelse af reaktionsresultater:Maskiner lærer kemi
- NASA-NOAA-satellitten ser den massive tropiske storm Krosa
- ivrig efter at forlade skandalen, Nissan viser glat køreteknologi


