Hvorfor har molekylære forbindelser lave smeltepunkter og kogende i forhold til ioniske stoffer?
1. Van der Waals Forces vs. Ionic Bonds:
- Van der Waals-kræfter:Disse kræfter inkluderer London-spredningskræfter, dipol-dipol-kræfter og inducerede dipol-dipol-kræfter. De er relativt svage attraktioner, der opstår som følge af de midlertidige fluktuationer i elektronfordelingen inden for molekyler. Generelt er van der Waals-kræfter svagere end ionbindinger.
- Ionbindinger:Ioniske bindinger er stærke elektrostatiske kræfter, der skyldes fuldstændig overførsel af elektroner fra et atom til et andet, hvilket skaber modsat ladede ioner. Tiltrækningen mellem disse ioner er meget stærkere end de intermolekylære kræfter, der er til stede i molekylære forbindelser.
2. Smelte- og kogepunkter:
- Smeltepunkt:Et stofs smeltepunkt repræsenterer den temperatur, ved hvilken det skifter fra fast til flydende tilstand. Den energi, der kræves for at overvinde de intermolekylære kræfter og tillade molekylerne at bevæge sig forbi hinanden, bestemmer smeltepunktet. Da ionbindinger er betydeligt stærkere end van der Waals-kræfter, kræver ioniske forbindelser mere energi for at bryde deres ionbindinger og smelte, hvilket resulterer i højere smeltepunkter.
- Kogepunkt:På samme måde er et stofs kogepunkt den temperatur, hvorved det går fra en flydende til en gasformig tilstand. Den energi, der skal til for at overvinde de intermolekylære kræfter og omdanne væsken til en damp, bestemmer kogepunktet. Igen fører de stærkere ionbindinger i ionforbindelser til højere kogepunkter sammenlignet med molekylære forbindelser med svagere van der Waals-kræfter.
3. Eksempler:
- Molekylære forbindelser med svage van der Waals-kræfter, såsom metan (CH4), har lave smeltepunkter (-182,5 °C) og kogepunkter (-161,6 °C).
- I modsætning hertil har ioniske forbindelser som natriumchlorid (NaCl), holdt sammen af stærke ionbindinger, meget højere smeltepunkter (801 °C) og kogepunkter (1465 °C).
Derfor fører tilstedeværelsen af svagere van der Waals-kræfter i molekylære forbindelser til lavere smeltepunkter og kogepunkter sammenlignet med ioniske forbindelser med stærke ionbindinger.
Sidste artikelHvad er en fysisk egenskab ved kæmpe kovalent struktur?
Næste artikelHvad betyder kæmpe kovalent?
 Varme artikler
Varme artikler
-
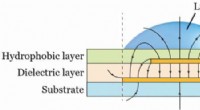 Hydrogel 3-D udskrivning og mønster af væsker med kondensatorkanteffekten (PLEEC)Princippet om PLEEC. En asymmetrisk kondensator er adskilt af et dielektrisk lag. Kredit:Science Advances, doi:10.1126/sciadv.aau8769 Hydrogeler er tredimensionelle (3-D) polymernetværk, der kan t
Hydrogel 3-D udskrivning og mønster af væsker med kondensatorkanteffekten (PLEEC)Princippet om PLEEC. En asymmetrisk kondensator er adskilt af et dielektrisk lag. Kredit:Science Advances, doi:10.1126/sciadv.aau8769 Hydrogeler er tredimensionelle (3-D) polymernetværk, der kan t -
 Kemiske biologer afdækker årsagen til en sjælden hjernesygdommaj Khanna, PhD, venstre, bruger 3D-briller til at hjælpe med at visualisere et molekyle skabt i hendes laboratorium. Kredit:Nadia Whitehead / UA College of Medicine -Tucson Babyer født med pontoc
Kemiske biologer afdækker årsagen til en sjælden hjernesygdommaj Khanna, PhD, venstre, bruger 3D-briller til at hjælpe med at visualisere et molekyle skabt i hendes laboratorium. Kredit:Nadia Whitehead / UA College of Medicine -Tucson Babyer født med pontoc -
 Ingeniører er pionerer i platinskaldannelsesprocessen, opnå første observation nogensindeEn skal af platin vokser lag for lag under iltudglødning. Kredit:Pan Group / UCI UCI-forskere har udtænkt en ny metode til dynamisk at danne en platinskal på en nanopartikelkerne af metallisk lege
Ingeniører er pionerer i platinskaldannelsesprocessen, opnå første observation nogensindeEn skal af platin vokser lag for lag under iltudglødning. Kredit:Pan Group / UCI UCI-forskere har udtænkt en ny metode til dynamisk at danne en platinskal på en nanopartikelkerne af metallisk lege -
 Uventet ny dynamik for store DNA -molekyler i flydende suspensionKredit:CC0 Public Domain Polymerfysikere ved University of Massachusetts Amherst rapporterer i dag om den uventede og tidligere ukendte opførsel af et ladet makromolekyle, såsom DNA indlejret i en
Uventet ny dynamik for store DNA -molekyler i flydende suspensionKredit:CC0 Public Domain Polymerfysikere ved University of Massachusetts Amherst rapporterer i dag om den uventede og tidligere ukendte opførsel af et ladet makromolekyle, såsom DNA indlejret i en
- Tiger, næsehorn flygter til højere terræn i Indiens oversvømmelsesramte Assam
- Sådan fungerer underjordisk minedrift
- Lockheed SR-71 Blackbird
- En blazar i det tidlige univers
- NASAs infrarøde opfattelse afp Kraftfulde storme omkring tyfonen Norus øje
- Hvad er der tilbage, når du fordamper fortyndet svovlsyre?


