Hvorfor er thiophen mindre basisk end furan?
Ilt er mere elektronegativt end svovl. Det betyder, at oxygenatomet i furan tiltrækker elektroner stærkere end svovlatomet i thiophen. Som følge heraf holdes det enlige elektronpar på oxygenatomet i furan tættere og er mindre tilgængeligt for interaktion med en proton. Dette gør furan mindre basisk end thiophen.
En anden måde at se det på er at overveje resonansstrukturerne af furan og thiophen. I furan kan det enlige elektronpar på oxygenatomet delokaliseres til ringens pi-system og danne en resonansstruktur med en positiv ladning på oxygenatomet. Denne resonansstruktur bidrager til den overordnede stabilitet af furan og gør den mindre reaktiv over for protonering.
I tilfælde af thiophen er det enlige elektronpar på svovlatomet mindre i stand til at delokalisere sig til ringens pi-system på grund af svovlatomets større størrelse og dets svagere elektronegativitet. Dette betyder, at der er mindre resonansstabilisering i thiophen, hvilket gør det mere reaktivt over for protonering og dermed mere basisk end furan.
Sammenfattende resulterer svovls lavere elektronegativitet sammenlignet med oxygen i en svagere tiltrækning mellem svovl og det enlige elektronpar, hvilket gør thiophen mere basisk end furan.
Sidste artikelEr pH på 13 en svag syre eller stærk base?
Næste artikelHvad er et eksempel på en molekylær formel for diatomisk molekyle?
 Varme artikler
Varme artikler
-
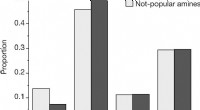 Kemikere viser, hvordan bias kan dukke op i resultater fra maskinlæringsalgoritmeren, Andelen efter udfald for hver reaktion, ved hjælp af resultatskalaen beskrevet i Metoder, for de populære og ikke-populære aminer i det menneskevalgte datasæt. b, Estimeret sandsynlighed for at ob
Kemikere viser, hvordan bias kan dukke op i resultater fra maskinlæringsalgoritmeren, Andelen efter udfald for hver reaktion, ved hjælp af resultatskalaen beskrevet i Metoder, for de populære og ikke-populære aminer i det menneskevalgte datasæt. b, Estimeret sandsynlighed for at ob -
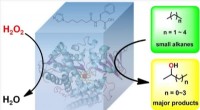 Forskere tager skridt mod mere effektive brændstofraffineringsprocesserKonstruktion af et enzym, der ensartet vil fremskynde de små alkaners reaktion på hydroxylgrupper, der er nødvendige for at producere brændstof. Kredit:CONG Zhiqi, Qingdao Institut for Bioenergi og Bi
Forskere tager skridt mod mere effektive brændstofraffineringsprocesserKonstruktion af et enzym, der ensartet vil fremskynde de små alkaners reaktion på hydroxylgrupper, der er nødvendige for at producere brændstof. Kredit:CONG Zhiqi, Qingdao Institut for Bioenergi og Bi -
 Forskeren udvikler bæredygtigt grønt te-baseret læderalternativDenne prototype af den grønne te-materialebaserede sko er et bæredygtigt alternativ til lædersko. Det blev skabt af Auburn-forskeren Young-A Lee. Kredit:Auburn University i Montgomery En global be
Forskeren udvikler bæredygtigt grønt te-baseret læderalternativDenne prototype af den grønne te-materialebaserede sko er et bæredygtigt alternativ til lædersko. Det blev skabt af Auburn-forskeren Young-A Lee. Kredit:Auburn University i Montgomery En global be -
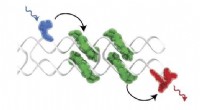 Lær af fotosyntese:Syntetiske kredsløb kan høste lysenergiSet i gråt, DNA DX-flisen danner et stillads, der muliggør en præcis placering af farvestofmolekyle kromoforer, som samler sig selv på stilladset i karakteristiske J-konfigurationer, ses i grønt. Blå
Lær af fotosyntese:Syntetiske kredsløb kan høste lysenergiSet i gråt, DNA DX-flisen danner et stillads, der muliggør en præcis placering af farvestofmolekyle kromoforer, som samler sig selv på stilladset i karakteristiske J-konfigurationer, ses i grønt. Blå
- Hvor er alle kulstofferne i en ring af glukose?
- Hybride enzymkatalysatorer syntetiseret ved en de novo tilgang til udvidelse af biokatalyse
- Høj ydeevne, organiske nanotråd fototransistorer åbner vejen for optoelektronisk enhedsminiaturis…
- 3D nano-blæk flytter branchegrænser
- Elektronmikroskopi giver fingerpeg om den farverige kemi af guldsmedevinger
- Ny ultrahurtig billedteknologi med høj billedhastighed og billednummer


