Hvorfor har atomer en tendens til at binde andre atomer?
1) Stabilitet . Atomer er mere stabile, når de er bundet til andre atomer. Dette skyldes, at når atomer er bundet, deler de elektroner, hvilket skaber en mere stabil elektronkonfiguration. For eksempel har et brintatom én elektron, hvilket gør det meget reaktivt. Men når brintatomer binder sammen for at danne brintgas (H2), deler hvert atom sin elektron med det andet atom, hvilket skaber et mere stabilt molekyle.
2) Energi . Når atomer binder, frigiver de energi. Denne energi kan bruges til at udføre arbejde, såsom at flytte genstande eller generere elektricitet. For eksempel, når brint- og oxygenatomer bindes til vand, frigiver de energi i form af varme og lys. Denne energi kan bruges til at drive køretøjer, generere elektricitet og opvarme boliger.
3) Reaktivitet . Atomer, der er mere reaktive, er mere tilbøjelige til at binde sig til andre atomer. Dette skyldes, at reaktive atomer har mere energi at sætte ind i den kemiske binding. For eksempel er natrium et meget reaktivt metal, der let binder sig til andre grundstoffer, såsom klor, for at danne forbindelser såsom natriumchlorid (NaCl).
4) Elektronkonfiguration . Et atoms elektronkonfiguration bestemmer, hvor mange elektroner det kan dele med andre atomer. For eksempel er atomer med en fuld ydre elektronskal meget stabile og har ikke tendens til at binde sig til andre atomer. Imidlertid er atomer med en ufuldstændig ydre elektronskal mere tilbøjelige til at binde sig til andre atomer for at fuldende deres elektronskal.
5) Størrelse . Størrelsen af et atom kan også påvirke dets tendens til at binde sig til andre atomer. Mindre atomer har en højere elektrontæthed end større atomer, hvilket gør dem mere tilbøjelige til at binde sig til andre atomer. For eksempel er kulstof et lille atom, der let binder til andre atomer, såsom brint, oxygen og nitrogen, for at danne en lang række forbindelser.
 Varme artikler
Varme artikler
-
 En teori så klar som glasForskere ved University of Tokyo bruger computersimuleringer til at modellere virkningerne af grundstofsammensætning på metalblandingers glasdannende evne, hvilket kan føre til hårde, elektrisk ledend
En teori så klar som glasForskere ved University of Tokyo bruger computersimuleringer til at modellere virkningerne af grundstofsammensætning på metalblandingers glasdannende evne, hvilket kan føre til hårde, elektrisk ledend -
 Kunstigt sødemiddel kunne en dag give kræftbehandlinger med færre bivirkningerKredit:American Chemical Society Kunstige sødestoffer bruges i diætdrikke og fødevarer, men kan også en dag bruges som behandlinger rettet mod kulsyreanhydrase IX (CA IX), et protein forbundet med
Kunstigt sødemiddel kunne en dag give kræftbehandlinger med færre bivirkningerKredit:American Chemical Society Kunstige sødestoffer bruges i diætdrikke og fødevarer, men kan også en dag bruges som behandlinger rettet mod kulsyreanhydrase IX (CA IX), et protein forbundet med -
 Meget selvlysende blæk fremstillet af kobber-jod hybridklynger med aggregeringsinduceret emissionKredit:Wiley Kinesiske videnskabsmænd har forvandlet kobber-jod-klyngemolekyler til aggregerede, stærkt luminescerende nanostrukturer til brug i lysdioder (LEDer). Faststofsamlingerne lavet af kom
Meget selvlysende blæk fremstillet af kobber-jod hybridklynger med aggregeringsinduceret emissionKredit:Wiley Kinesiske videnskabsmænd har forvandlet kobber-jod-klyngemolekyler til aggregerede, stærkt luminescerende nanostrukturer til brug i lysdioder (LEDer). Faststofsamlingerne lavet af kom -
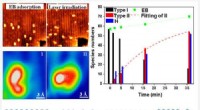 Forskere opdager CH-bindingsaktiveringsreaktioner ved lav temperatur ved foto-inducerede midlerHøjopløselig STM, der visualiserer reaktionens mellemtilstande og reaktionsvejen for EB-dehydrogenering på TiO2. Kredit:WANG Haochen CH-bindingen er meget vigtig i organisk kemi. Kemiske reaktione
Forskere opdager CH-bindingsaktiveringsreaktioner ved lav temperatur ved foto-inducerede midlerHøjopløselig STM, der visualiserer reaktionens mellemtilstande og reaktionsvejen for EB-dehydrogenering på TiO2. Kredit:WANG Haochen CH-bindingen er meget vigtig i organisk kemi. Kemiske reaktione
- Hvordan man observerer en sort huls symfoni ved hjælp af gravitationsbølgeastronomi
- Hvordan hjælper biodiversitet et økosystem?
- Ny kvanteslynge giver testbed til kvantekommunikationsteknologi
- AI er en beskidt lille hemmelighed:Den drives af mennesker
- Forskere studerer overfladerne af ceria-nanopartikler
- Astronomer finder kosmisk guldnål begravet i to årtier


