Hvorfor er diffusionshastigheden i væske langsommere end gasser?
1. Højere molekylær densitet:Væsker har en højere molekylær densitet sammenlignet med gasser. Det betyder, at der er flere molekyler per volumenenhed i en væske, hvilket gør det sværere for individuelle molekyler at bevæge sig og diffundere. I gasser er molekylerne mere spredt ud, hvilket giver mulighed for hurtigere diffusion.
2. Stærkere intermolekylære kræfter:De intermolekylære kræfter mellem væskemolekyler er generelt stærkere end dem i gasser. Disse kræfter, såsom hydrogenbinding, dipol-dipol-interaktioner og van der Waals-kræfter, skaber et sammenhængende miljø, der begrænser molekylernes bevægelse. I gasser er de intermolekylære kræfter svagere, hvilket tillader molekyler at bevæge sig mere frit.
3. Viskositet:Viskositet er et mål for en væskes modstand mod strømning. Væsker har højere viskositeter sammenlignet med gasser. Det betyder, at det kræver mere energi for molekyler at overvinde friktionskræfterne og bevæge sig gennem en væske. I gasser er viskositeten lavere, hvilket gør det muligt for molekyler at diffundere hurtigere.
4. Temperaturafhængighed:Diffusionshastigheden i både væsker og gasser stiger med temperaturen. Temperaturens effekt på diffusionen er dog mindre udtalt i væsker sammenlignet med gasser. Dette skyldes, at de stærkere intermolekylære kræfter i væsker hindrer den temperaturinducerede stigning i molekylær bevægelse. I gasser giver de svagere intermolekylære kræfter mulighed for en mere signifikant indflydelse af temperaturen på diffusionen.
Sammenfattende bidrager den højere molekylære tæthed, stærkere intermolekylære kræfter, højere viskositet og svagere temperaturafhængighed i væsker til en langsommere diffusionshastighed sammenlignet med gasser.
Sidste artikelHvorfor er chloroform ikke brændbart?
Næste artikelHvad er et lanthanidelement?
 Varme artikler
Varme artikler
-
 Firefly-gen belyser evnen hos optimeret CRISPR-Cpf1 til effektivt at redigere menneskeligt genomProfessor Michael Farzan, medformand for TSRIs afdeling for immunologi og mikrobiologi. Kredit:Scripps Research Institute Forskere på Florida campus ved The Scripps Research Institute (TSRI) har f
Firefly-gen belyser evnen hos optimeret CRISPR-Cpf1 til effektivt at redigere menneskeligt genomProfessor Michael Farzan, medformand for TSRIs afdeling for immunologi og mikrobiologi. Kredit:Scripps Research Institute Forskere på Florida campus ved The Scripps Research Institute (TSRI) har f -
 Koordinationspolymerglas giver solid støtte til brintbrændselscellerMolekylstrukturen af det nye polymerglas letter bevægelsen af protoner (H+) hen over det under tørre forhold ved 120 ° C. Kredit:Mindy Takamiya/Kyoto University iCeMS Forskere ved Japans Insti
Koordinationspolymerglas giver solid støtte til brintbrændselscellerMolekylstrukturen af det nye polymerglas letter bevægelsen af protoner (H+) hen over det under tørre forhold ved 120 ° C. Kredit:Mindy Takamiya/Kyoto University iCeMS Forskere ved Japans Insti -
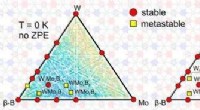 Forskere forudsiger nyt, hårdt, og superhårde ternære forbindelserTernær fasediagram over W-Mo-B-systemet ved 0 K. Kredit:A. Kvashnin et al./Chemistry of Materials Forskere fra Skolkovo Institute of Science and Technology (Skoltech), Institute of Solid State Che
Forskere forudsiger nyt, hårdt, og superhårde ternære forbindelserTernær fasediagram over W-Mo-B-systemet ved 0 K. Kredit:A. Kvashnin et al./Chemistry of Materials Forskere fra Skolkovo Institute of Science and Technology (Skoltech), Institute of Solid State Che -
 En lille cirkulær racerbane for lys kan hurtigt opdage enkelte molekylerEnkeltmolekylesensoren, forstørret 1, 700 gange på dette billede, er smallere end diameteren af det gennemsnitlige menneskehår. Lette løb rundt om ringen øverst. Kredit:Little Sensor Lab, University
En lille cirkulær racerbane for lys kan hurtigt opdage enkelte molekylerEnkeltmolekylesensoren, forstørret 1, 700 gange på dette billede, er smallere end diameteren af det gennemsnitlige menneskehår. Lette løb rundt om ringen øverst. Kredit:Little Sensor Lab, University
- Hvad er laboratoriefremstillingen af oxygen ved hjælp af manganij dioxid?
- At planlægge at bringe sten tilbage fra Mars er vores bedste bud på at finde spor fra tidligere li…
- Forskere afslører magnetiske genforbindelsesdetaljer, der udløser solglødetrådsudbrud
- Grønning på høje breddegrader kan hæmme udvidelsen af mellembredde-ørkener
- Afsløring af teknologier til fremtidige løfteraketter
- Aldrende befolkninger vil trække væksten i Asien i langdrag:IMF-chef


