Firefly-gen belyser evnen hos optimeret CRISPR-Cpf1 til effektivt at redigere menneskeligt genom

Professor Michael Farzan, medformand for TSRI's afdeling for immunologi og mikrobiologi. Kredit:Scripps Research Institute
Forskere på Florida campus ved The Scripps Research Institute (TSRI) har forbedret en state-of-the-art genredigeringsteknologi for at fremme systemets evne til at målrette, klippe og indsætte gener i mennesker og dyreceller-og udvide måderne, hvorpå CRISPR-Cpf1-redigeringssystemet kan bruges til at studere og bekæmpe menneskelige sygdomme.
Professor Michael Farzan, medformand for TSRI's afdeling for immunologi og mikrobiologi, og TSRI Research Associate Guocai Zhong forbedrede effektiviteten af CRISPR-Cpf1 genredigeringssystemet ved at inkorporere guide-RNA'er med "multiplexering" -kapacitet.
Guide RNA'er er korte nukleinsyrestrenge, der leder CRISPR -molekylsaksene til deres påtænkte genmål. TSRI-opdagelsen betyder, at flere genetiske mål i en celle kan blive ramt af hvert CRISPR-Cpf1-kompleks.
"Dette system forenkler og forbedrer effektiviteten af samtidig redigering af flere gener, eller flere steder i et enkelt gen, "Zhong sagde." Dette kan være meget nyttigt, når flere sygdomsrelaterede gener eller flere steder i et sygdomsrelateret gen skal målrettes. "
"Denne fremgangsmåde forbedrer genredigering for en række applikationer, "Tilføjede Farzan." Systemet gør nogle applikationer mere effektive og andre applikationer mulige. "
Denne undersøgelse blev offentliggjort som et avanceret onlinepapir i tidsskriftet Naturens kemiske biologi den 19. juni, 2017.
TSRI Advance gør CRISPR mere effektiv
Forkortelse for "Clustered Regularly Interspaced Short Palindromic Repeat, "CRISPR -genredigeringssystemet udnytter en ældgammel bakteriel immunforsvarsproces. Nogle mikrober modvirker virusinfektion ved at spærre et stykke af et viruss fremmed genetiske materiale i sit eget DNA, at tjene som skabelon. Næste gang den virale sekvens støder på mikroben, det genkendes straks og skæres til bortskaffelse ved hjælp af to typer RNA. Molekyler kaldet guide RNA'er giver kortet til invadereren, og CRISPR -effektorproteiner fungerer som saksen, der skærer den fra hinanden.
I løbet af de sidste fem år har CRISPR -genredigeringssystemet har revolutioneret mikrobiologien og fornyet håbet om, at genteknologi i sidste ende kan blive en nyttig behandling af sygdomme.
Men tiden har afsløret teknologiens begrænsninger. For en, genterapi kræver i øjeblikket at bruge en viral skal til at fungere som leveringspakke til det terapeutiske genetiske materiale. CRISPR -molekylet er simpelthen for stort til at passe med flere guide -RNA'er i det mest populære og nyttige virale emballagesystem.
Den nye undersøgelse fra Farzan og kolleger hjælper med at løse dette problem ved at lade forskere pakke flere vejledende RNA'er.
Dette fremskridt kan være vigtigt, hvis genterapi skal behandle sygdomme som hepatitis B, Sagde Farzan. Efter infektion, hepatitis B DNA sidder i leverceller, langsomt styre produktionen af nye vira, i sidste ende fører til leverskade, skrumpelever og endda kræft. Det forbedrede CRISPR-Cpf1-system, med sin evne til at 'multiplexere, 'kunne mere effektivt fordøje det virale DNA, før leveren er uigenkaldeligt beskadiget, han sagde.
"Effektivitet er vigtig. Hvis du ændrer 25 celler i leveren, det er meningsløst. Men hvis du ændrer halvdelen af cellerne i leveren, det er kraftfuldt, "Sagde Farzan." Der er andre gode tilfælde - f.eks. Muskeldystrofi - hvor hvis du kan reparere genet i nok muskelceller, du kan genoprette muskelfunktionen. "
To typer af disse molekylære saks bruges nu i vid udstrækning til genredigeringsformål:Cas9 og Cpf1. Farzan sagde, at han fokuserede på Cpf1, fordi det er mere præcist i pattedyrsceller. Cpf1 -molekylet, de undersøgte, stammer fra to typer bakterier, Lachnospiraceae bakterie og Acidaminococus sp., hvis aktivitet tidligere er blevet undersøgt i E. coli. En vigtig egenskab ved disse molekyler er, at de er i stand til at få fat i deres guide -RNA'er ud af en lang streng af sådan RNA; men det var ikke klart, at det ville fungere med RNA produceret fra pattedyrceller. Guocai testede denne idé ved at redigere et ildfluebioluminescensgen i cellens kromosom. Det modificerede CRISPR-Cpf1-system fungerede som forventet.
"Det betyder, at vi kan bruge enklere leveringssystemer til at styre CRISPR -effektorproteinet plus guide -RNA'er, "Farzan sagde." Det kommer til at gøre CRISPR -processen mere effektiv til en række forskellige applikationer. "
Ser frem til, Farzan sagde, at Cpf1 -proteinet skal forstås mere bredt, så dets anvendelighed til at levere genterapivektorer kan udvides yderligere.
 Varme artikler
Varme artikler
-
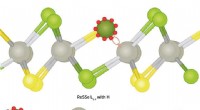 Defekter i nanopartikler hjælper med at drive produktionen af brint, et rent brændende brændsto…En rheniumbaseret nanopartikel indeholdende lige store mængder svovl og selen, mangler dog nogle svovlatomer (nederst til højre), vist sig at være den mest effektive elektrokatalysator. Kredit:America
Defekter i nanopartikler hjælper med at drive produktionen af brint, et rent brændende brændsto…En rheniumbaseret nanopartikel indeholdende lige store mængder svovl og selen, mangler dog nogle svovlatomer (nederst til højre), vist sig at være den mest effektive elektrokatalysator. Kredit:America -
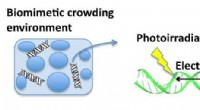 Elektronoverførsel og oxidativ skade i DNA i et biomimetisk trængselmiljøKredit:University of Electro Communications Det er kendt, at et elektronhul bevæger sig gennem dobbeltspiralformet DNA og inducerer oxidativ skade på guaninsteder. Til dato, denne proces er kun bl
Elektronoverførsel og oxidativ skade i DNA i et biomimetisk trængselmiljøKredit:University of Electro Communications Det er kendt, at et elektronhul bevæger sig gennem dobbeltspiralformet DNA og inducerer oxidativ skade på guaninsteder. Til dato, denne proces er kun bl -
 Måling af eliminering af plastikpartikler fra kroppen hos musFigur 1. PET-CT billeder af mus ved 6, 12, 24, og 48 timer efter oral administration af 20 nm polystyrenpartikler (øverste række) og 1 µm polystyrenpartikler (nederste række). Grøn kant:MIP, blå kant:
Måling af eliminering af plastikpartikler fra kroppen hos musFigur 1. PET-CT billeder af mus ved 6, 12, 24, og 48 timer efter oral administration af 20 nm polystyrenpartikler (øverste række) og 1 µm polystyrenpartikler (nederste række). Grøn kant:MIP, blå kant: -
 Skaber ringe i naturlig antibiotikasynteseTværfaglige undersøgelser afslører, hvordan naturen skaber et globalt brugt antibiotikum. Kredit:University of Bristol Forskere ved University of Bristol har afsløret hemmelighederne bag nøglering
Skaber ringe i naturlig antibiotikasynteseTværfaglige undersøgelser afslører, hvordan naturen skaber et globalt brugt antibiotikum. Kredit:University of Bristol Forskere ved University of Bristol har afsløret hemmelighederne bag nøglering


