Hvor mange gram o2 skal der til for at forbrænde 96,6 c3h8 fuldstændigt?
$$2C_3H_8 + 7O_2 \højrepil 6CO_2 + 8H_2O$$
Ifølge støkiometrien af den afbalancerede kemiske ligning kræver 2 mol C3H8 7 mol O2 for fuldstændig forbrænding.
Den molære masse af C3H8 er 44,1 g/mol, og den molære masse af O2 er 32,0 g/mol.
Derfor er massen af O2, der kræves for fuldstændigt at forbrænde 96,6 g C3H8:
$$96,6 \text{ g C}_3H_8 \times \frac{7 \text{ mol O}_2}{2 \text{ mol C}_3H_8} \times \frac{32.0 \text{ g O}_2}{\text { mol O}_2} =\boxed{1042 \text{ g O}_2}$$
Derfor skal der 1042 gram O2 til for fuldstændig at forbrænde 96,6 gram C3H8.
Sidste artikelEr en svampeblanding eller et rent stof?
Næste artikelHvordan opretholder maven forhold ved pH 2?
 Varme artikler
Varme artikler
-
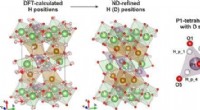 Forskere afslører kompleks defekt struktur af Li-ion katode materialeGrafisk abstrakt. Kredit: Uorganisk kemi (2021). DOI:10.1021/acs.inorgchem.0c03241 Skoltech-forskere har undersøgt hydroxyl-defekterne i LiFePO 4 , et meget udbredt katodemateriale i kommerciel
Forskere afslører kompleks defekt struktur af Li-ion katode materialeGrafisk abstrakt. Kredit: Uorganisk kemi (2021). DOI:10.1021/acs.inorgchem.0c03241 Skoltech-forskere har undersøgt hydroxyl-defekterne i LiFePO 4 , et meget udbredt katodemateriale i kommerciel -
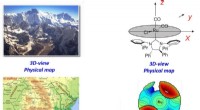 Kortlægning af den tredimensionelle struktur af katalytiske centre hjælper med at designe nye og f…3D -strukturen af landskabsbilledet (øverst til venstre) kan sammenlignes med 3D -billedet af katalysatoren (øverst til højre). Tilsvarende det geografiske kort (nederst til venstre) kan sammenligne
Kortlægning af den tredimensionelle struktur af katalytiske centre hjælper med at designe nye og f…3D -strukturen af landskabsbilledet (øverst til venstre) kan sammenlignes med 3D -billedet af katalysatoren (øverst til højre). Tilsvarende det geografiske kort (nederst til venstre) kan sammenligne -
 Risforskere forenkler inkorporeringen af nitrogen i molekylerRice Universitets elektrofile amineringsmidler muliggør hurtig dannelse af carbon-nitrogenbindinger, der er kernen i en lang række kemiske forbindelser, herunder størstedelen af lægemiddelkandidater
Risforskere forenkler inkorporeringen af nitrogen i molekylerRice Universitets elektrofile amineringsmidler muliggør hurtig dannelse af carbon-nitrogenbindinger, der er kernen i en lang række kemiske forbindelser, herunder størstedelen af lægemiddelkandidater -
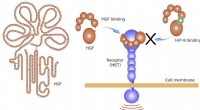 HGF-hæmmende makrocyklisk peptid-mekanismer og potentielle kræftteranostikaHGF udøver sine fysiologiske funktioner ved at binde til sin receptor MET på cellemembranen. Ved binding af HiP-8 til HGF, HGF -binding til receptoren MET hæmmes (højre side af figuren). Kredit:Kanaza
HGF-hæmmende makrocyklisk peptid-mekanismer og potentielle kræftteranostikaHGF udøver sine fysiologiske funktioner ved at binde til sin receptor MET på cellemembranen. Ved binding af HiP-8 til HGF, HGF -binding til receptoren MET hæmmes (højre side af figuren). Kredit:Kanaza
- Hvad er kemikalierne i majsstivelse?
- Sådan opdages en defekt solenoid
- Hurtigt accelererende gletschere kan øge, hvor hurtigt havniveauet stiger
- Astronomer kortlægger afstande til 56.000 galakser, det største katalog nogensinde
- Mekanismen for arktisk kold luft bryder ud i Eurasien
- Sporing af celler med omnidirektionelle synlige laserpartikler


