Hvornår kan en opløsning af svag base være mere ætsende end stærk base?
Hydrolyse er et stofs reaktion med vand, og det kan føre til dannelse af hydroxidioner (OH-). Omfanget af hydrolyse afhænger af basens styrke. Stærke baser undergår hydrolyse i mindre grad end svage baser, fordi de er mere fuldstændig ioniseret i vand. Det betyder, at de producerer færre hydroxidioner, hvilket gør deres opløsninger mindre ætsende.
Derimod undergår svage baser hydrolyse i højere grad, fordi de er mindre fuldstændigt ioniseret i vand. Dette resulterer i dannelsen af flere hydroxidioner, hvilket gør deres opløsninger mere ætsende. Derudover er den konjugerede syre i en svag base generelt stærkere end den konjugerede syre i en stærk base. Det betyder, at den svage base vil protonere vand i højere grad, frigive flere H+ ioner og sænke opløsningens pH. Opløsningens lavere pH kan bidrage til dens ætsende egenskaber.
For eksempel er en opløsning af ammoniak (NH3), en svag base, mere ætsende end en opløsning af natriumhydroxid (NaOH), en stærk base, med samme koncentration. Dette skyldes, at ammoniak undergår hydrolyse i højere grad end natriumhydroxid, hvilket producerer flere hydroxidioner og gør opløsningen mere ætsende.
Sidste artikelHvilke kemikalier forårsager afskum?
Næste artikelHvilken gas er farveløs i et periodisk system?
 Varme artikler
Varme artikler
-
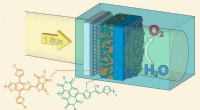 Et kunstigt blad lavet af halvledende polymererGenerering af ilt fra sollys, vand og halvledende polymerer. Kredit:LIMNO / EPFL EPFL-forskere genererer ilt fra sollys, vand og halvledende polymerer. De præsenterer en lovende vej mod økonomisk
Et kunstigt blad lavet af halvledende polymererGenerering af ilt fra sollys, vand og halvledende polymerer. Kredit:LIMNO / EPFL EPFL-forskere genererer ilt fra sollys, vand og halvledende polymerer. De præsenterer en lovende vej mod økonomisk -
 Teamet tester virkningerne af ilt på uranVist på en stor computerskærm er et Raman-spektrum af uranoxidpartikler dannet inde i holdets reaktionskammer på bænken. Det viste uranoxidspektrum er for U3 O8 . Kredit:Julie Russell/LLNL Et team
Teamet tester virkningerne af ilt på uranVist på en stor computerskærm er et Raman-spektrum af uranoxidpartikler dannet inde i holdets reaktionskammer på bænken. Det viste uranoxidspektrum er for U3 O8 . Kredit:Julie Russell/LLNL Et team -
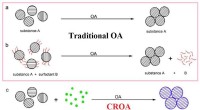 Nyt stof kan dannes i den orienterede vedhæftningsproces med krystalvækst, undersøgelse afslører1a, Traditionel orienteret fastgørelse (OA) af nanopartikler for at danne en enkelt krystal. Fig. 1b, Ved hjælp af overfladeaktive stoffer (røde bølgede linjer) kan der også dannes en enkelt krystal v
Nyt stof kan dannes i den orienterede vedhæftningsproces med krystalvækst, undersøgelse afslører1a, Traditionel orienteret fastgørelse (OA) af nanopartikler for at danne en enkelt krystal. Fig. 1b, Ved hjælp af overfladeaktive stoffer (røde bølgede linjer) kan der også dannes en enkelt krystal v -
 Zink regulerer lagring og frigivelse af neurotransmittereZink er et vigtigt mikronæringsstof involveret i mange cellulære processer:F.eks. i lærings- og hukommelsesprocesser, det spiller en rolle, som endnu ikke er forstået. Ved at bruge nanoelektrokemiske
Zink regulerer lagring og frigivelse af neurotransmittereZink er et vigtigt mikronæringsstof involveret i mange cellulære processer:F.eks. i lærings- og hukommelsesprocesser, det spiller en rolle, som endnu ikke er forstået. Ved at bruge nanoelektrokemiske
- Robopets:Brug af teknologi til at overvåge ældre voksne rejser bekymringer om privatlivets fred
- Undersøgelse identificerer en yderligere hindring for udbredt plantning af bioenergiafgrøder
- Den ofte hørte klage om, at motorcykler kan påvirke løbets udfald, er berettiget
- To-dimensionelle multiferroiske i monolag gruppe IV monochalcogenider
- Hvad er forskellene mellem evolutionsteori og modstridende teorier?
- Billede:Atlas V løftes af med TDRS-M


