Hvad betyder en farveændring i en syre-base titrering?
Farveændringen er typisk forårsaget af tilstedeværelsen af en indikator , som er en kemisk forbindelse, der undergår en mærkbar farveændring afhængigt af opløsningens pH. Indikatorens farveændring er baseret på dens kemiske struktur og den måde, den interagerer med hydrogenioner (H+) i opløsningen.
Når syren og basen blandes under titreringen, ændres opløsningens pH. Efterhånden som syren tilsættes, falder pH på grund af en stigning i H+ ioner. Når pH når indikatorens specifikke endepunkt pH , gennemgår indikatoren en farveændring, hvilket signalerer fuldførelsen af titreringen.
Valget af den passende indikator er afgørende for nøjagtigt at bestemme endepunktet. Forskellige indikatorer har forskellige endpoint pH-områder og farveændringer. Indikatoren bør have et slutpunkts-pH tæt på ækvivalenspunktet for syre-base-reaktionen for at opnå de mest nøjagtige resultater.
For eksempel, i en typisk syre-base titrering med phenolphtalein som en indikator, er den oprindelige farve af opløsningen farveløs. Efterhånden som basen tilsættes, stiger pH, og opløsningen bliver gradvist lyserød. Når pH når endepunktet, som er omkring pH 8,3, gennemgår opløsningen en hurtig og dramatisk farveændring fra farveløs til pink. Dette indikerer, at titreringen er fuldført, og de tilsatte mol syre svarer til de mol base, der er til stede i opløsningen.
Farveændringen i syre-basetitreringen giver et visuelt signal om, at endepunktet er nået, hvilket muliggør en præcis bestemmelse af koncentrationen af den ukendte syre eller base i opløsningen, der titreres.
Sidste artikelHvad giver FeSO4 plus K3PO4?
Næste artikelEr alle opløsninger og blandinger løsninger?
 Varme artikler
Varme artikler
-
 At skabe nul-energihuse, giftfri glitter og fossilfri lim med træNulenergihus Luukku. Kredit:Montse Zamorano At bygge klogt med træ er en effektiv måde at bekæmpe klimaændringer på. Det er muligt at bygge næsten alt med træ, hvis vi udvikler vores ekspertise og
At skabe nul-energihuse, giftfri glitter og fossilfri lim med træNulenergihus Luukku. Kredit:Montse Zamorano At bygge klogt med træ er en effektiv måde at bekæmpe klimaændringer på. Det er muligt at bygge næsten alt med træ, hvis vi udvikler vores ekspertise og -
 Det mest detaljerede røntgenbillede af batterier har endnu ikke afsløret, hvorfor de stadig ikke e…Dybdegående beregningsmodeller af kommercielle lithium-ion batterielektroder afslører specifikt, hvor der sker skade ved brug. Kredit:Purdue University billede/Kejie Zhao Elbiler er afhængige af d
Det mest detaljerede røntgenbillede af batterier har endnu ikke afsløret, hvorfor de stadig ikke e…Dybdegående beregningsmodeller af kommercielle lithium-ion batterielektroder afslører specifikt, hvor der sker skade ved brug. Kredit:Purdue University billede/Kejie Zhao Elbiler er afhængige af d -
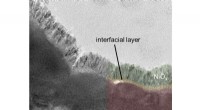 Solbrint:Fotoanoder lover høj effektivitetTEM-billede af en α-SnWO4 film (grøn) overtrukket med 20 nm NiOx (pink). Ved grænsefladen mellem α-SnWO4 og NiOx kan et yderligere grænsefladelag observeres. Kredit:HZB Fotoanoder fremstillet af m
Solbrint:Fotoanoder lover høj effektivitetTEM-billede af en α-SnWO4 film (grøn) overtrukket med 20 nm NiOx (pink). Ved grænsefladen mellem α-SnWO4 og NiOx kan et yderligere grænsefladelag observeres. Kredit:HZB Fotoanoder fremstillet af m -
 Ingeniører gør injicerbare væv til en realitetDoktorand Mohamed Gamal bruger en nyudviklet celleindkapslingsanordning. Kredit:Nathan Skolski, UBC Okanagan En simpel injektion, der kan hjælpe med at genskabe beskadiget væv, har længe været drø
Ingeniører gør injicerbare væv til en realitetDoktorand Mohamed Gamal bruger en nyudviklet celleindkapslingsanordning. Kredit:Nathan Skolski, UBC Okanagan En simpel injektion, der kan hjælpe med at genskabe beskadiget væv, har længe været drø


