Hvad er den procentvise sammensætning af calciumfluorid?
Procentsammensætning =(grundstofmasse/samlet masse) x 100
Da calciumfluorid er sammensat af calcium (Ca) og fluor (F), er vi nødt til at kende deres atommasse:
Atommasse af Ca =40,078 g/mol
Atommasse af F =18,998 g/mol
I calciumfluorid er der et calciumatom og to fluoratomer. Så vi skal beregne molmassen af calciumfluorid:
Molær masse =(1 x atommasse af Ca) + (2 x atommasse af F)
=(1 x 40,078 g/mol) + (2 x 18,998 g/mol)
=78,074 g/mol
Nu kan vi beregne den procentvise sammensætning af calcium og fluor i calciumfluorid:
Procent Calcium =(Calciummasse/molmasse) x 100
=(40,078 g/mol / 78,074 g/mol) x 100
=51,35 %
Procent fluor =(Fluormasse/molmasse) x 100
=(2 x 18,998 g/mol / 78,074 g/mol) x 100
=48,65 %
Derfor er den procentvise sammensætning af calciumfluorid 51,35% calcium og 48,65% fluor.
Sidste artikelHvordan adskiller man ammoniak fra brint?
Næste artikelHvorfor er vand en væske ved stp, mens kuldioxid er gas?
 Varme artikler
Varme artikler
-
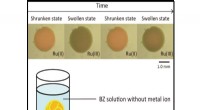 Less is more:En blød, selvbetjent pumpe for at forenkle mekatroniske enhederBelousov-Zhabotinsky hydrogel i opløsning. Kredit:Shibaura Institute of Technology Moderne mekatroniske enheder, fra industrimaskiner til robotter, har set en drastisk stigning i kompleksitet og f
Less is more:En blød, selvbetjent pumpe for at forenkle mekatroniske enhederBelousov-Zhabotinsky hydrogel i opløsning. Kredit:Shibaura Institute of Technology Moderne mekatroniske enheder, fra industrimaskiner til robotter, har set en drastisk stigning i kompleksitet og f -
 Levende elektroder med bakterier og organisk elektronikGábor Méhes, forsker ved Linköpings Universitet. Fotokredit Thor Balkhed Forskere ved Laboratory of Organic Electronics, Linköpings Universitet, har sammen med kolleger ved Lawrence Berkeley Natio
Levende elektroder med bakterier og organisk elektronikGábor Méhes, forsker ved Linköpings Universitet. Fotokredit Thor Balkhed Forskere ved Laboratory of Organic Electronics, Linköpings Universitet, har sammen med kolleger ved Lawrence Berkeley Natio -
 Menisk-assisteret teknik producerer højeffektiv perovskite PV-filmOptisk mikrofotografi af perovskitkrystalkorn fremstillet ved menisk-assisteret opløsningsudskrivning. Kredit:Ming He, Georgia Tech En ny lavtemperatur-løsningsudskrivningsteknik muliggør fremstil
Menisk-assisteret teknik producerer højeffektiv perovskite PV-filmOptisk mikrofotografi af perovskitkrystalkorn fremstillet ved menisk-assisteret opløsningsudskrivning. Kredit:Ming He, Georgia Tech En ny lavtemperatur-løsningsudskrivningsteknik muliggør fremstil -
 Ion billard cue ny materialesyntesemetodeEn skematisk illustration af den nyudviklede Proton-Driven Ion Introduction (PDII) metode. Protoner genereret ved elektrisk adskillelse af brint skydes ind i forsyningskilden for de ønskede ioner. Ion
Ion billard cue ny materialesyntesemetodeEn skematisk illustration af den nyudviklede Proton-Driven Ion Introduction (PDII) metode. Protoner genereret ved elektrisk adskillelse af brint skydes ind i forsyningskilden for de ønskede ioner. Ion
- Hvad er caiumchlorid?
- Klar elev en? Universiteter lancerer grader i e-sport
- Afsløring af jordskælv i Aserbajdsjans større Kaukasus-bjerge
- Hvordan man producerer den reneste argon nogensinde
- Mange amerikanske førskolebørn forbliver raceadskilt i skolen
- Overvejer du at byde en ukrainsk flygtning velkommen i dit hjem? Vores forskning kan hjælpe dig med…


