Hvad er egenskaberne ved en gas?
1. Lydstyrke :Gasser optager hele volumen af den beholder, de er i. De udvider sig for at fylde den tilgængelige plads.
2. Form :Gasser har ikke en bestemt form. De tager form af den beholder, de er i.
3. Tæthed :Gasser har en relativt lav densitet sammenlignet med faste stoffer og væsker.
4. Tryk :Gasser udøver pres på væggene i den beholder, de befinder sig i. Trykket stiger, når temperaturen stiger, eller volumenet falder.
5. Diffusion :Gasser kan diffundere eller spredes ud af sig selv og blandes med andre gasser.
6. Termisk udvidelse :Gasser udvider sig, når de opvarmes og trækker sig sammen, når de afkøles.
7. Kompressibilitet :Gasser er let komprimerbare, hvilket betyder, at deres volumen kan reduceres ved at påføre tryk.
8. Molekylær bevægelse :Gaspartikler er i konstant hurtig bevægelse og bevæger sig i lige linjer, indtil de kolliderer med andre partikler eller beholderens vægge.
9. Kinetisk energi :Gaspartiklerne har kinetisk energi, som er bevægelsesenergien. Temperaturen af en gas er et mål for dens partiklers gennemsnitlige kinetiske energi.
10. Kollisioner :Gaspartikler kolliderer med hinanden og med beholderens vægge. Disse kollisioner er for det meste elastiske, hvilket betyder, at partiklernes samlede kinetiske energi bevares.
Forståelse af gassers egenskaber er vigtig inden for forskellige områder såsom kemi, fysik og teknik, og har anvendelser på mange områder, herunder gaslagring, transport, opvarmning og industrielle processer.
Sidste artikelHvorfor bruge h2so4 i stedet for hcl i titrering kmno4?
Næste artikelHvilken forbindelse har sandsynligvis ikke ionbindinger?
 Varme artikler
Varme artikler
-
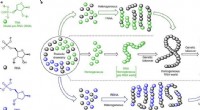 Forskere foreslår, at RNA og DNA startede med RNA-DNA-kimæreren, Konstitutionel formelrepræsentation af de tre oligonukleotid -byggesten, der blev undersøgt i denne undersøgelse. b, Tre mulige scenarier for fremkomsten af RNA og DNA fra præbiotisk kemi. Midt:
Forskere foreslår, at RNA og DNA startede med RNA-DNA-kimæreren, Konstitutionel formelrepræsentation af de tre oligonukleotid -byggesten, der blev undersøgt i denne undersøgelse. b, Tre mulige scenarier for fremkomsten af RNA og DNA fra præbiotisk kemi. Midt: -
 Kemisk tiltrækning giver klapperslange peptid bid på superbugsKredit:University of Queensland Forskere har vist, hvorfor et fragment af et protein fra klappekirtlen hos klapperslanger kunne være grundlaget for et alternativ til konventionelle antibiotika. U
Kemisk tiltrækning giver klapperslange peptid bid på superbugsKredit:University of Queensland Forskere har vist, hvorfor et fragment af et protein fra klappekirtlen hos klapperslanger kunne være grundlaget for et alternativ til konventionelle antibiotika. U -
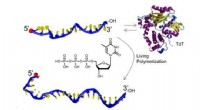 Oddball-enzym giver nem vej til syntetiske biomaterialerNy opskrift bruger overset DNA-builder til at forenkle produktionen af syntetiske biomaterialer til applikationer lige fra lægemiddellevering til nanotråde. Kredit:Stefan Zauscher, Duke University
Oddball-enzym giver nem vej til syntetiske biomaterialerNy opskrift bruger overset DNA-builder til at forenkle produktionen af syntetiske biomaterialer til applikationer lige fra lægemiddellevering til nanotråde. Kredit:Stefan Zauscher, Duke University -
 At finde nye anvendelser for affaldsdækScrap Tire-programmet kombinerede ressourcer og ekspertise fra den akademiske verden og regeringen i staten Delaware i håb om at afbøde et problem, der kan skade miljøet og mennesker. Kredit:Universit
At finde nye anvendelser for affaldsdækScrap Tire-programmet kombinerede ressourcer og ekspertise fra den akademiske verden og regeringen i staten Delaware i håb om at afbøde et problem, der kan skade miljøet og mennesker. Kredit:Universit
- Fysikere når telegrafi på atomare skala med lys
- Satellit ser den tropiske cyklon Luban nærme sig Oman
- Karakteriserer strukturen af selvsamlende organiske molekyler på overfladen af nanopartikler
- Forskere transformerer, hvordan komplekse havdata fra Ocean Health Index syntetiseres, kommunikeres
- Gamma-ray laser flytter et skridt tættere på virkeligheden
- Kaldes MnSO4 også Epsom salt?


