Hvorfor kaldes kovalente bindinger retningsbindinger?
Retningsevnen af kovalente bindinger skyldes, at de atomare orbitaler, der overlapper hinanden for at danne bindingerne, har specifikke former. For eksempel er s-orbitaler sfæriske, p-orbitaler er håndvægtsformede, og d-orbitaler har mere komplekse former. Når disse orbitaler overlapper hinanden, danner de elektronpar, der er koncentreret i overlapningsområderne.
Retningsevnen af kovalente bindinger har vigtige konsekvenser for molekylers egenskaber. For eksempel bestemmer det bindingsvinklerne og -længderne, og det påvirker også molekylets overordnede form. Retningsevnen af kovalente bindinger er også afgørende for at forstå kemiske reaktioner, da det bestemmer, hvordan atomer kan binde sammen for at danne nye molekyler.
Her er nogle eksempler på, hvordan retningsbestemmelsen af kovalente bindinger påvirker egenskaberne af molekyler:
* Bindningsvinkler: Bindingsvinklen mellem to atomer bestemmes af overlapningen af deres atomare orbitaler. For eksempel i et vandmolekyle er H-O-H-bindingsvinklen 104,5 grader, fordi oxygenatomets p-orbitaler overlapper med brintatomernes s-orbitaler på en tetraedrisk måde.
* Båndlængder: Bindingslængden mellem to atomer bestemmes af afstanden mellem deres atomkerner. Bindingslængden påvirkes af atomernes størrelse og bindingens styrke. For eksempel er C-C-bindingslængden i ethan 1,54 Å, mens C-C-bindingslængden i ethylen er 1,34 Å. Denne forskel i bindingslængde skyldes, at C-C-bindingen i ethan er en enkeltbinding, mens C-C-bindingen i ethylen er en dobbeltbinding.
* Molekylær form: Den molekylære form af et molekyle bestemmes af arrangementet af dets atomer og retningsbestemmelsen af dets kovalente bindinger. For eksempel er vandmolekylet et bøjet molekyle på grund af det tetraedriske arrangement af dets atomer. Metanmolekylet er et tetraedrisk molekyle på grund af det tetraedriske arrangement af dets carbonatoms p-orbitaler.
Retningsevnen af kovalente bindinger er en grundlæggende egenskab ved molekyler, der har en dyb indvirkning på deres egenskaber og adfærd.
 Varme artikler
Varme artikler
-
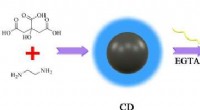 Kulstofprikker gør calcium lettere at sporeIllustration af Ca2+ -detektering ved hjælp af EGTA-modificerede cder. Kredit:SIBET På hospitaler, læger råder ofte patienter til at tage calciumtilskud. Men kommer calcium ind i de celler, der ha
Kulstofprikker gør calcium lettere at sporeIllustration af Ca2+ -detektering ved hjælp af EGTA-modificerede cder. Kredit:SIBET På hospitaler, læger råder ofte patienter til at tage calciumtilskud. Men kommer calcium ind i de celler, der ha -
 Mikro-/nano-arkitekturer i MOF-membran fremskynder olie-vandseparation(en, b) SEM-billeder og (c) af AFM-billede ZIF-8-belagt mesh-membran; (d) Fotografiet af flere oliedråber på ZIF-8-belagt mesh-membran. Kredit:© Science China Press Hyppige olieudslip under olietr
Mikro-/nano-arkitekturer i MOF-membran fremskynder olie-vandseparation(en, b) SEM-billeder og (c) af AFM-billede ZIF-8-belagt mesh-membran; (d) Fotografiet af flere oliedråber på ZIF-8-belagt mesh-membran. Kredit:© Science China Press Hyppige olieudslip under olietr -
 Video:Der er guld i havvand! Kan vi udtrække det?Kredit:The American Chemical Society Havet har omkring 20 millioner tons guld i sig - det er omkring 700 TRILLIONER DOLLAR guld værd! I denne episode af Reaktioner , vi undersøger, hvordan folk i
Video:Der er guld i havvand! Kan vi udtrække det?Kredit:The American Chemical Society Havet har omkring 20 millioner tons guld i sig - det er omkring 700 TRILLIONER DOLLAR guld værd! I denne episode af Reaktioner , vi undersøger, hvordan folk i -
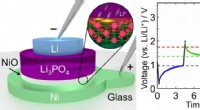 Lille, hurtig, og meget energieffektiv hukommelsesenhed inspireret af lithium-ion-batterierDe stablede lag i den foreslåede hukommelsesenhed danner et minibatteri, der hurtigt og effektivt kan skiftes mellem tre forskellige spændingstilstande (0,95 V, 1,35 V, og 1,80 V). Kredit:ACS Applied
Lille, hurtig, og meget energieffektiv hukommelsesenhed inspireret af lithium-ion-batterierDe stablede lag i den foreslåede hukommelsesenhed danner et minibatteri, der hurtigt og effektivt kan skiftes mellem tre forskellige spændingstilstande (0,95 V, 1,35 V, og 1,80 V). Kredit:ACS Applied
- Har jorden altid haft lige så meget ilt?
- Én størrelse passer ikke alle, når man skal undersøge, hvordan kulstof i jorden påvirker klimae…
- Simulering viser, hvordan eksponering for plasma får kulstofnanorør til at vokse
- Ny beregningsmetode giver mere præcise forudsigelser af, hvordan atomer ioniserer, når de påvirke…
- Grafenbaserede diske sikrer sikker opbevaring
- Røg på vandet - og i mikrofon?


