Hvad bidrog John Dalton til forståelsen af atomet?
Loven om bevarelse af messen: Ifølge Daltons lov kan masse hverken skabes eller ødelægges i en kemisk reaktion. Den samlede masse af produkterne i en reaktion er lig med den samlede masse af reaktanterne.
Loven om bestemte proportioner: Daltons lov siger, at når to grundstoffer kombineres for at danne en forbindelse, gør de det altid i en fast og bestemt masseforhold. Denne lov understøtter ideen om, at atomer af forskellige grundstoffer har forskellige masser.
Flere proportioner: Dalton observerede, at når to grundstoffer danner mere end én forbindelse, er masserne af et grundstof, der kombineres med en fast masse af det andet grundstof, i et simpelt heltalsforhold. Dette koncept hjalp med at forklare, hvorfor grundstoffer kombineres i specifikke forhold for at danne forskellige forbindelser.
Atomsymboler: Dalton introducerede brugen af simple symboler til at repræsentere forskellige elementer. Disse symboler, såsom "O" for oxygen og "H" for brint, gjorde det lettere at skrive kemiske formler og kommunikere om forbindelser.
Empiriske formler: Daltons arbejde med atomvægte og multiple proportioner førte til udviklingen af empiriske formler, som repræsenterer de enkleste hele talforhold mellem grundstoffer til stede i en forbindelse.
Daltons bidrag til forståelsen af atomet lagde grundlaget for moderne kemi. Hans teori og love tilvejebragte en ramme for forståelse af stoffets sammensætning og adfærd, hvilket satte scenen for yderligere videnskabelige fremskridt inden for kemi.
Sidste artikelHvordan er syrer og baser forskellige, hvordan er deres pH-værdier forskellige?
Næste artikelHvad gør bikarbonat-ioner?
 Varme artikler
Varme artikler
-
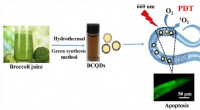 Nem model med høj gennemstrømning til evaluering af effektiviteten af fotodynamisk middelNem model med høj kapacitet til at evaluere effektiviteten af fotodynamisk middel. Kredit:Shereen M. El-Sherbiny For nylig leverede forskere ledet af prof. Huang Qing ved Hefei Institutes of Phys
Nem model med høj gennemstrømning til evaluering af effektiviteten af fotodynamisk middelNem model med høj kapacitet til at evaluere effektiviteten af fotodynamisk middel. Kredit:Shereen M. El-Sherbiny For nylig leverede forskere ledet af prof. Huang Qing ved Hefei Institutes of Phys -
 Ny tilgang til gasfangst fremmer styring af atombrændstofAdskillelse af 85 Kr fra brugt nukleart brændstof ved en meget selektiv metalorganisk ramme. Kredit:Mike Gipple/NETL Atomenergi leverer omkring 20 procent af den amerikanske elforsyning, og over
Ny tilgang til gasfangst fremmer styring af atombrændstofAdskillelse af 85 Kr fra brugt nukleart brændstof ved en meget selektiv metalorganisk ramme. Kredit:Mike Gipple/NETL Atomenergi leverer omkring 20 procent af den amerikanske elforsyning, og over -
 Bæredygtig brændstof til verden:Syntetisering af ammoniak ved brug af mindre energiAmmoniak (NH3) er et af de vigtigste industrikemikalier i dag, syntetiseret globalt til brug i gødning, der derefter muliggør fødevareproduktion for cirka 70% af verdens befolkning. Ammoniak opnås i ø
Bæredygtig brændstof til verden:Syntetisering af ammoniak ved brug af mindre energiAmmoniak (NH3) er et af de vigtigste industrikemikalier i dag, syntetiseret globalt til brug i gødning, der derefter muliggør fødevareproduktion for cirka 70% af verdens befolkning. Ammoniak opnås i ø -
 En keramisk resurfacing-protese til hofteledDe støbte halvskaller til resurfacing af proteser er struktureret på den ene side for at forbedre knoglecellevedhæftningen. Kredit:Den anden side er helt glat. Fraunhofer IKTS Den hofteoverfladepr
En keramisk resurfacing-protese til hofteledDe støbte halvskaller til resurfacing af proteser er struktureret på den ene side for at forbedre knoglecellevedhæftningen. Kredit:Den anden side er helt glat. Fraunhofer IKTS Den hofteoverfladepr
- Værktøjer tilskynder til energibesparelser med smarte termostater
- Udnyttelse af potentialet ved kvantetunneling:Transistorer uden halvledere
- Byggeaffald skal omdannes til gasmasker og sportsudstyr
- Neutrinoer, atomure og et eksperiment til at opdage en tidsudvidelse
- En optisk taktil sensor med flere kameraer, der kunne muliggøre vision-baserede robotskin
- Facebook udtrykker bekymring over forbuddet i Sri Lanka


