Hvorfor er kobberhydroxid en svag base?
1. Sur dissociation:Cu(OH)2(s) ⇌ Cu2+(aq) + 2OH-(aq)
I denne reaktion donerer kobberhydroxid H+-ioner til vand og danner Cu2+-ioner og hydroxidioner. Denne dissociation resulterer i en let sur opløsning.
2. Grundlæggende dissociation:Cu(OH)2(s) + H2O(l) ⇌ Cu(OH)4^2-(aq) + 2H+(aq)
I denne reaktion accepterer kobberhydroxid H+-ioner fra vand, danner tetrahydroxokobber(II)-kompleksionen, Cu(OH)4^2-, og frigiver H+-ioner. Denne dissociation bidrager til kobberhydroxids svagt grundlæggende egenskaber.
Omfanget af sur og basisk dissociation afhænger af koncentrationen af kobberhydroxid og opløsningens pH. Generelt er kobberhydroxid mere sur i fortyndede opløsninger og mere basisk i koncentrerede opløsninger.
Fordi kobberhydroxid kan deltage i både sure og basiske dissociationsreaktioner, udviser det ikke stærke basiske egenskaber som typiske baser såsom natriumhydroxid (NaOH) eller kaliumhydroxid (KOH), som dissocierer fuldstændigt i vand og frigiver hydroxidioner.
 Varme artikler
Varme artikler
-
 Forskning afdækker potentiel bæredygtig raffineringsmetode for ligninKredit:CC0 Public Domain Lignin, bruges som en vedvarende ressource til at producere produkter af høj værdi, har givet både produktionsmæssige og økonomiske udfordringer for bioraffinaderidriften.
Forskning afdækker potentiel bæredygtig raffineringsmetode for ligninKredit:CC0 Public Domain Lignin, bruges som en vedvarende ressource til at producere produkter af høj værdi, har givet både produktionsmæssige og økonomiske udfordringer for bioraffinaderidriften. -
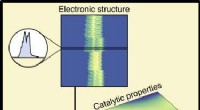 Maskinlæring forbinder materialesammensætning og ydeevne i katalysatorerKredit:University of Michigan I et fund, der kunne være med til at bane vejen mod renere brændstoffer og en mere bæredygtig kemisk industri, forskere ved University of Michigan har brugt maskinlær
Maskinlæring forbinder materialesammensætning og ydeevne i katalysatorerKredit:University of Michigan I et fund, der kunne være med til at bane vejen mod renere brændstoffer og en mere bæredygtig kemisk industri, forskere ved University of Michigan har brugt maskinlær -
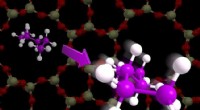 Forskere opdager, hvordan burmolekyler rasler og syngerHexan, et molekyle med seks carbonatomer, vil vælte, spin og vibrere mindre i et nanoporøst bur, men den kan stadig bevæge sig i to dimensioner. Kredit:Catalysis Center for Energy Innovation Et te
Forskere opdager, hvordan burmolekyler rasler og syngerHexan, et molekyle med seks carbonatomer, vil vælte, spin og vibrere mindre i et nanoporøst bur, men den kan stadig bevæge sig i to dimensioner. Kredit:Catalysis Center for Energy Innovation Et te -
 Et skridt tættere på at forstå eksplosiv følsomhed med molekyledesignDaniel Preston (til venstre), Virginia Manner (i midten) og Geoff Brown udarbejder en slagvægtstest på et eksplosivt PETN-derivat. Kredit:Los Alamos National Laboratory Sprængstoffer har et iboend
Et skridt tættere på at forstå eksplosiv følsomhed med molekyledesignDaniel Preston (til venstre), Virginia Manner (i midten) og Geoff Brown udarbejder en slagvægtstest på et eksplosivt PETN-derivat. Kredit:Los Alamos National Laboratory Sprængstoffer har et iboend
- Efter oversvømmelseskatastrofen i Vesttyskland:Videnskaben søger efter svar
- Nanomateriale med potentiale til at tackle flere globale udfordringer kan udvikles uden risiko for m…
- Hvordan konverterer man 0,0295 mol lithium til gram?
- Sådan konverteres punkthældningsform til hældningsaflytningsformular
- Tvinger vindmølleparker fugle til at flyve i gården? ISU-forsker vil have adskilt fakta fra varm l…
- For at fremme menneskerettighederne, konsultere neurovidenskab


