Hvad er antallet af mol oxygengas, der skal til for at reagere med 4,0 Mg?
$$2Mg(s) + O_2(g) → 2MgO(s)$$
Denne ligning fortæller os, at 2 mol Mg reagerer med 1 mol O2. Først skal vi konvertere den givne masse af Mg (4,0 g) til mol ved hjælp af dens molære masse (24,305 g/mol):
$$4.0\text{ g Mg} \times \frac{1\text{ mol Mg}}{24.305\text{ g Mg}} =0,164\text{ mol Mg}$$
Ifølge den afbalancerede kemiske ligning kræves der 1 mol O2 for hver 2 mol Mg. Derfor er antallet af mol oxygengas, der er nødvendigt for at reagere med 0,164 mol Mg:
$$0,164\text{ mol Mg} \times \frac{1\text{ mol O}_2}{2\text{ mol Mg}} =0,082\text{ mol O}_2$$
Derfor kræves 0,082 mol oxygengas for at reagere med 4,0 g Mg.
Sidste artikelEr Na3P et kulbrinte eller salt?
Næste artikelHvad er pH-værdien af svovl og nitrogen?
 Varme artikler
Varme artikler
-
 Denne RNA-baserede teknik kunne gøre genterapi mere effektivKredit:CC0 Public Domain Levering af funktionelle gener til celler for at erstatte muterede gener, en metode kendt som genterapi, har potentiale til behandling af mange former for sygdomme. De tid
Denne RNA-baserede teknik kunne gøre genterapi mere effektivKredit:CC0 Public Domain Levering af funktionelle gener til celler for at erstatte muterede gener, en metode kendt som genterapi, har potentiale til behandling af mange former for sygdomme. De tid -
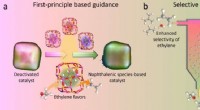 Forskere regenererer deaktiveret katalysator i methanol-til-olefin-processena. Første-principbaserede simuleringer giver kriterierne for stabilitet og funktionalitet af organiske mellemprodukter indespærret i nano-hulrum. b Selektiv omdannelse af koks til en specifik naphthal
Forskere regenererer deaktiveret katalysator i methanol-til-olefin-processena. Første-principbaserede simuleringer giver kriterierne for stabilitet og funktionalitet af organiske mellemprodukter indespærret i nano-hulrum. b Selektiv omdannelse af koks til en specifik naphthal -
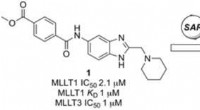 Opdagelse af selektive kemiske prober, der hæmmer epigenetiske faktorer for akut myeloid leukæmiKredit:Wiley Nogle alvorlige former for leukæmi udvikler sig, fordi proteiner på det epigenetiske niveau mister deres regulerende funktion. Nu, i et bredt internationalt samarbejde, Britiske forsk
Opdagelse af selektive kemiske prober, der hæmmer epigenetiske faktorer for akut myeloid leukæmiKredit:Wiley Nogle alvorlige former for leukæmi udvikler sig, fordi proteiner på det epigenetiske niveau mister deres regulerende funktion. Nu, i et bredt internationalt samarbejde, Britiske forsk -
 Genbrugsbeton kan være en bæredygtig måde at holde murbrokkerne væk fra lossepladserShahria Alam, meddirektør for UBCs Green Construction Research and Training Center og den ledende efterforsker af undersøgelsen. Kredit:UBC Okanagan Resultaterne af en ny fem-årig undersøgelse af
Genbrugsbeton kan være en bæredygtig måde at holde murbrokkerne væk fra lossepladserShahria Alam, meddirektør for UBCs Green Construction Research and Training Center og den ledende efterforsker af undersøgelsen. Kredit:UBC Okanagan Resultaterne af en ny fem-årig undersøgelse af
- Hvordan man laver en model af jordens årstider
- Hvad er et kaliumchlorat i naturen?
- Hvordan klimaforandringer og brande former fremtidens skove
- Hvordan global opvarmning kan få dyr til at skrumpe
- Opløselighedsundersøgelse kan påvirke energi, biologi, miljø
- 'Synes godt om' Facebook-aktier? Eksperter vægter børsintroduktionen


