Er temperaturen ubetydelig effekt på opløseligheden af Nacl?
Forholdet mellem temperatur og opløseligheden af NaCl kan beskrives ved hjælp af følgende ligning:
```
ln(S) =m × (1/T) + b
```
hvor:
- S er opløseligheden af NaCl i gram pr. liter
- T er den absolutte temperatur i Kelvin
- m og b er konstanter
Hældningen af linjen (m) i ligningen repræsenterer ændringen i opløseligheden af NaCl med temperaturen. Jo stejlere hældning, jo større effekt har temperaturen på opløseligheden. For NaCl er hældningen positiv, hvilket indikerer, at opløseligheden stiger med stigende temperatur.
Følgende tabel viser opløseligheden af NaCl i vand ved forskellige temperaturer:
| Temperatur (°C) | Opløselighed (g/L) |
|---|---|
| 0 | 35,7 |
| 25 | 36,0 |
| 50 | 37,2 |
| 75 | 38,4 |
| 100 | 39,8 |
Som det kan ses af tabellen, stiger opløseligheden af NaCl med ca. 3 g/L for hver 25°C temperaturstigning. Denne stigning er dog relativt lille sammenlignet med den samlede opløselighed af NaCl, som er omkring 36 g/l ved stuetemperatur. Derfor, mens temperatur har en effekt på opløseligheden af NaCl, er det ikke en væsentlig faktor i de fleste applikationer.
Sidste artikelHvad er den kemiske formel for monosvovldioxid?
Næste artikelHvordan fortynder man en syre?
 Varme artikler
Varme artikler
-
 Ultrastrækbare og deformerbare bioprober ved hjælp af Kirigami-designUltrastrækbar Kirigami bioprobe enhed. Den strakte enhed (øverste billede) og enheden placeret over det biologiske væv (nederste billede). Kredit:Toyohashi University of Technology. Et forskerhold
Ultrastrækbare og deformerbare bioprober ved hjælp af Kirigami-designUltrastrækbar Kirigami bioprobe enhed. Den strakte enhed (øverste billede) og enheden placeret over det biologiske væv (nederste billede). Kredit:Toyohashi University of Technology. Et forskerhold -
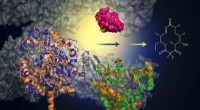 Forskere udvikler grønnere og mere effektiv metode til fremstilling af næste generations antibioti…Med tilføjelsen af en murin-afledt biokatalysator (grøn), kan dette konstruerede protein tilføje et fluoridatom for at skabe makrolidanaloger (struktur, til højre). Denne tilgang tilbyder en grønner
Forskere udvikler grønnere og mere effektiv metode til fremstilling af næste generations antibioti…Med tilføjelsen af en murin-afledt biokatalysator (grøn), kan dette konstruerede protein tilføje et fluoridatom for at skabe makrolidanaloger (struktur, til højre). Denne tilgang tilbyder en grønner -
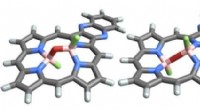 Opdagelse til at gruppere atomer påkalder PasteurForskernes molekyler ændrer form ved, at det centrale oxygenatom (vist med rødt) bøjer sig som et hængsel. De venstre og højre billeder viser, hvad formerne på disse molekyler er, når de er stabile. H
Opdagelse til at gruppere atomer påkalder PasteurForskernes molekyler ændrer form ved, at det centrale oxygenatom (vist med rødt) bøjer sig som et hængsel. De venstre og højre billeder viser, hvad formerne på disse molekyler er, når de er stabile. H -
 En 40-årig katalysator afslører sine hemmelighederKredit:CC0 Public Domain Titanium silicalite-1 (TS-1) er ikke en ny katalysator:Det er næsten 40 år siden udviklingen og opdagelsen af dets evne til at omdanne propylen til propylenoxid, et vigt
En 40-årig katalysator afslører sine hemmelighederKredit:CC0 Public Domain Titanium silicalite-1 (TS-1) er ikke en ny katalysator:Det er næsten 40 år siden udviklingen og opdagelsen af dets evne til at omdanne propylen til propylenoxid, et vigt
- Featherweight oxygen discovery åbner vindue om nuklear symmetri
- Sådan fungerer flydende broer
- Måling af mekanisk stabilitet af kraftoverførings supramolekylære forbindelser
- Fremtidige virkninger af forurening
- 60 døde i jordskred, oversvømmelser i Indonesias hovedstad
- Ny metode kan skinne et helbredende lys på hjernen for dem med bevægelsesforstyrrelser


