Forskere udvikler grønnere og mere effektiv metode til fremstilling af næste generations antibiotika
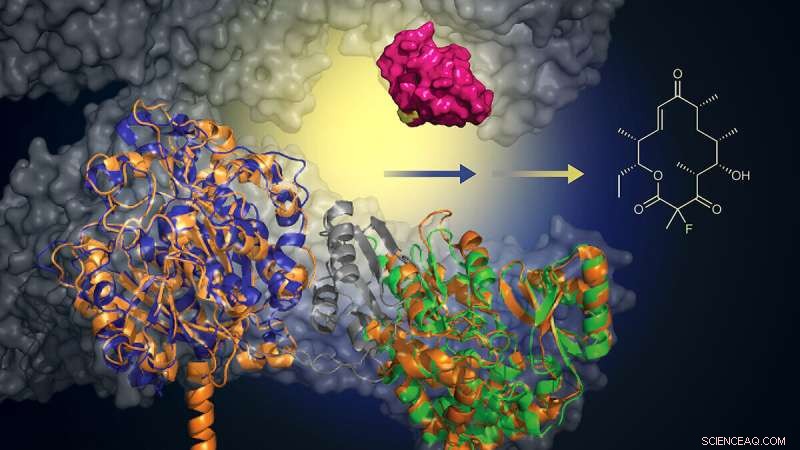
Med tilføjelsen af en murin-afledt biokatalysator (grøn), kan dette konstruerede protein tilføje et fluoridatom for at skabe makrolidanaloger (struktur, til højre). Denne tilgang tilbyder en grønnere og mere effektiv metode til at skabe nye antibiotika. Kredit:Martin Grininger og Rajani Arora
Et internationalt hold af forskere har udviklet en metode til at ændre én klasse af antibiotika ved hjælp af mikroskopiske organismer, der producerer disse forbindelser naturligt.
Resultaterne, offentliggjort den 25. juli i Nature Chemistry , kunne føre til mere effektiv produktion af antibiotika, der er effektive mod lægemiddelresistente bakterier.
Holdet startede med en mikroorganisme, der er genetisk programmeret til at producere antibiotikumet erythromycin. Forskere fra Institut for Organisk Kemi og Kemi
Biologi ved det tyske Goethe-universitet undrede sig over, om systemet kunne ændres genetisk for at samle antibiotikummet med et ekstra fluoratom, hvilket ofte kan forbedre de farmaceutiske egenskaber.
"Vi havde analyseret fedtsyresyntese i flere år, da vi identificerede en del af et museprotein, som vi troede kunne bruges til rettet biosyntese af disse modificerede antibiotika, hvis det føjes til et biologisk system, der allerede kan lave den native forbindelse," sagde Martin Grininger, professor i biomolekylær kemi ved Goethe Universitet.
I samarbejde med David Shermans laboratorium ved University of Michigan, som er specialiseret i dette biologiske samlingssystem, brugte holdet proteinteknologi til at erstatte en del af systemets oprindelige maskineri med det funktionelt lignende musegen.
"Det er som at tage en motordel ud af en Mercedes og sætte den ind i en Porsche for at lave en bedre hybridmotor. Du får en Porsche-motor, der kan nye ting og fungerer endnu bedre," siger Sherman, der er fakultetsmedlem ved U-M Life Sciences Institute og professor i medicinsk kemi i College of Pharmacy.
"Vi kan nu drage fordel af denne proteinteknologi til at lave nye forbindelser, der har dette meget ønskværdige fluoratom, som kemikere har kæmpet for at tilføje til makrolidantibiotika i lang tid."
Grunden til, at dette tilsatte fluoratom er så ønskeligt, er, at det ikke kun ændrer strukturen af det endelige produkt, men også produktets evne til at dræbe bakterier og arbejde sikkert hos patienter.
Erythromycin virker ved at binde sig til og blokere aktiviteten af det bakterielle ribosom, som er afgørende for, at bakterier kan overleve. Nogle bakterier har udviklet måder at forhindre denne binding på, hvilket gør dem resistente over for behandling med antibiotika. Ændring af antibiotikummets struktur med et fluoratom overvinder den evolutionære fordel og genopretter forbindelsens evne til at bekæmpe bakterier.
Mens kemikere har udviklet metoder til at tilsætte fluor syntetisk, er processen besværlig og kræver brug af giftige kemiske reagenser. Den nye biosyntesemetode udviklet af forskerne fra Goethe Universitet og U-M overvinder disse udfordringer.
"Det er en meget spændende udvikling, fordi vi kan omgå alle de tidskrævende syntetiske trin og farlige kemikalier," sagde Sherman. "Vi har vist, at vi grundlæggende kan omprogrammere en organisme til at lave det fluorerede produkt direkte."
Forskerne understreger, at de fluorerede forbindelser stadig er et par år fra at være tilgængelige i klinikken. Men resultaterne giver en mere effektiv vej frem til udvikling af nye antibiotika og endda antivirale og anti-cancer medicin.
"Vores tilgang har vist sig at være vellykket på et lille sæt antibiotika, men det kan i sidste ende bruges til at udvikle en bred vifte af lægemidler med minimal brug af giftige kemikalier og biprodukter," sagde Grininger. + Udforsk yderligere
Proteinstruktur giver fingerpeg om lægemiddelresistensmekanismen
 Varme artikler
Varme artikler
-
 Neutralisering af patogene svampe med småmolekylære immunterapeutikaKredit:Wiley Svampeinfektioner repræsenterer en stigende sundhedskrise, især for immundefekt patienter. Amerikanske forskere rapporterer nu i tidsskriftet Angewandte Chemie at specifik hjælp kun
Neutralisering af patogene svampe med småmolekylære immunterapeutikaKredit:Wiley Svampeinfektioner repræsenterer en stigende sundhedskrise, især for immundefekt patienter. Amerikanske forskere rapporterer nu i tidsskriftet Angewandte Chemie at specifik hjælp kun -
 En ny teori til at beskrive konjugerede polymer-polyelektrolytblandingerKlas Tybrandt ved Linköpings Universitet med kraftpapir. Han har fremlagt en teoretisk model, der forklarer koblingen mellem ioner og elektroner i den meget anvendte ledende polymer PEDOT:PSS. Modelle
En ny teori til at beskrive konjugerede polymer-polyelektrolytblandingerKlas Tybrandt ved Linköpings Universitet med kraftpapir. Han har fremlagt en teoretisk model, der forklarer koblingen mellem ioner og elektroner i den meget anvendte ledende polymer PEDOT:PSS. Modelle -
 Ferroelektriske selvsamlede molekylære materialerDet første materiale med konduktivitetsegenskaber, der kan tændes og slukkes ved hjælp af ferroelektrisk polarisering. Kredit:Thor Balkhed Professor Martijn Kemerink fra Linköping Universitet har
Ferroelektriske selvsamlede molekylære materialerDet første materiale med konduktivitetsegenskaber, der kan tændes og slukkes ved hjælp af ferroelektrisk polarisering. Kredit:Thor Balkhed Professor Martijn Kemerink fra Linköping Universitet har -
 Forskere udvikler unik polymerbelægning til at tackle skadelige svampeCandida albicans. Kredit:Wikipedia. Forskere fra University of Nottingham har udviklet en ny måde at kontrollere skadelige svampe på, uden behov for at bruge kemiske bioaktive stoffer som fungicid
Forskere udvikler unik polymerbelægning til at tackle skadelige svampeCandida albicans. Kredit:Wikipedia. Forskere fra University of Nottingham har udviklet en ny måde at kontrollere skadelige svampe på, uden behov for at bruge kemiske bioaktive stoffer som fungicid
- Giftige rester fra guldmine fundet i sneskoharer
- Forskning afslører en ny overlevelsesstrategi i nøglebakterier
- Ved beregning af de sociale omkostninger ved metan, egenkapital betyder noget
- Sådan opretter du et elektrisk felt uden magneter
- 8. klasse kemiske reaktionseksperimenter
- RNA-strengen muliggør indfangning af uracil i den kritiske tilstand


