Hvad er bindingsvinklen og molekylformen af siliciumdisulfid?
Denne molekylære geometri og bindingsvinkel kan forstås baseret på teori om valensskalelektronparrepulsion (VSEPR). I SiS$_2$ er det centrale siliciumatom (Si) bundet til to svovlatomer (S), hver gennem en dobbeltbinding. Silicium har fire valenselektroner, hvoraf to er involveret i dobbeltbindinger med hvert svovlatom. Dette efterlader to ensomme elektronpar på siliciumatomet.
Ifølge VSEPR-teorien vil arrangementet af elektronpar omkring et centralt atom antage en geometri, der minimerer frastødningen mellem dem. I tilfælde af SiS$_2$ er de to ensomme elektronpar på siliciumatomet orienteret så langt fra hinanden som muligt for at minimere elektron-elektron frastødning. Dette resulterer i den bøjede molekylære geometri med en bindingsvinkel på cirka 119,5 grader.
Den vinkelformede eller V-formede molekylære form af siliciumdisulfid er påvirket af frastødningen mellem de to enlige elektronpar på siliciumatomet og de bindingspar af elektroner, der er involveret i dobbeltbindingerne med svovlatomerne. Dette arrangement fører til en forvrænget tetraedrisk elektronpargeometri omkring siliciumatomet, hvilket giver anledning til den bøjede molekylære struktur.
 Varme artikler
Varme artikler
-
 Rød, hvid men sjældent blå - videnskaben om fyrværkerifarver, forklaretFyrværkeri er en klasse af eksplosive pyrotekniske enheder, der normalt findes i omkring syv farver. Kredit:Shahril KHMD/Shutterstock.com I de tidligste dage af USA, John Adams skrev til sin kone
Rød, hvid men sjældent blå - videnskaben om fyrværkerifarver, forklaretFyrværkeri er en klasse af eksplosive pyrotekniske enheder, der normalt findes i omkring syv farver. Kredit:Shahril KHMD/Shutterstock.com I de tidligste dage af USA, John Adams skrev til sin kone -
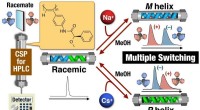 Multi-state omskiftelig stationær fase åbner nye døre i kiral adskillelseSkematisk illustration af tre-tilstands omskiftelig kiral stationær fase baseret på makromolekylær helicitetsmodulering i et poly (phenylacetylen) derivat ved hjælp af metalkationer i søjlen. Kredit:K
Multi-state omskiftelig stationær fase åbner nye døre i kiral adskillelseSkematisk illustration af tre-tilstands omskiftelig kiral stationær fase baseret på makromolekylær helicitetsmodulering i et poly (phenylacetylen) derivat ved hjælp af metalkationer i søjlen. Kredit:K -
 Hurtig identifikation af høj ydeevne, multi-element katalysatorerHundredvis af mulige materialekombinationer kan testes på bæreren. Kredit:Tobias Löffler Mange elektrokemiske reaktioner gennemgår flere trin. Hver skal optimeres på en katalysatoroverflade, hvis
Hurtig identifikation af høj ydeevne, multi-element katalysatorerHundredvis af mulige materialekombinationer kan testes på bæreren. Kredit:Tobias Löffler Mange elektrokemiske reaktioner gennemgår flere trin. Hver skal optimeres på en katalysatoroverflade, hvis -
 Et nyt materiale til gennemsigtige og fleksible displaysFigur 1. En TFT-enhed fremstillet på poly (amid-imid) film:A) Skematisk struktur af den transparente og fleksible IGZO TFT fremstillet på PAI (s-u). B) Elektriske egenskaber og C) transmittansspektre
Et nyt materiale til gennemsigtige og fleksible displaysFigur 1. En TFT-enhed fremstillet på poly (amid-imid) film:A) Skematisk struktur af den transparente og fleksible IGZO TFT fremstillet på PAI (s-u). B) Elektriske egenskaber og C) transmittansspektre
- Hvad er energisikkerhed, og hvordan har det ændret sig?
- I jagten på perfekt kemi - en vision om at forene katalyse
- Universiteter offentliggør resultater om nitrogenfodspor
- Vil automatiserede køretøjer fjerne stressen fra at køre? Forskning siger, at man ikke skal regne…
- Ny biosyntetisk vej unik for patogene mikroorganismer
- Farveskiftende materialer kunne beskytte nukleart materiale og andre værdifulde stoffer


