Hydrogenbinding eller koordinat - hvad er svagest?
Koordinatbindinger, også kendt som dativbindinger, dannes, når et atom donerer et par elektroner til et andet atom. Atomet, der donerer elektronerne, kaldes Lewis-basen, og det atom, der accepterer elektronerne, kaldes Lewis-syren. Koordinatbindinger er svagere end hydrogenbindinger, fordi den elektrostatiske tiltrækning mellem de to atomer er svagere. Dette skyldes, at elektronerne i en koordinatbinding ikke deles ligeligt mellem de to atomer, da de er i en brintbinding.
Generelt er hydrogenbindinger omkring 10 gange stærkere end koordinatbindinger. Styrken af en hydrogenbinding eller en koordinatbinding kan dog variere afhængigt af de specifikke involverede atomer.
 Varme artikler
Varme artikler
-
 Juicing teknik kan påvirke sundheden af friskpresset juiceKredit:CC0 Public Domain Med det nye år, mange mennesker tager beslutninger om at spise sundere, ved at spise flere grøntsager, for eksempel. Men dem, der ikke kan lide smagen eller konsistensen a
Juicing teknik kan påvirke sundheden af friskpresset juiceKredit:CC0 Public Domain Med det nye år, mange mennesker tager beslutninger om at spise sundere, ved at spise flere grøntsager, for eksempel. Men dem, der ikke kan lide smagen eller konsistensen a -
 Hård som en diamant? Forskere forudsiger nye former for superhårdt kulstofEn illustration viser tre af 43 nyligt forudsagte superhårde kulstofstrukturer. Bure farvet i blå er strukturelt relateret til diamant, og burene farvet i gul og grøn er strukturelt beslægtet med lons
Hård som en diamant? Forskere forudsiger nye former for superhårdt kulstofEn illustration viser tre af 43 nyligt forudsagte superhårde kulstofstrukturer. Bure farvet i blå er strukturelt relateret til diamant, og burene farvet i gul og grøn er strukturelt beslægtet med lons -
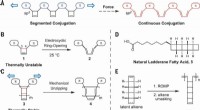 Ultralydsvibrationer tvinger en polymer til at være en halvlederDesign af mekanisk kemisk frembragt konjugeret polymer. (A) Isolerende CBE -mekanoforer forbundet med π -systemer, designet til at omarrangere til kontinuerligt forlænget konjugering under kraft. (B)
Ultralydsvibrationer tvinger en polymer til at være en halvlederDesign af mekanisk kemisk frembragt konjugeret polymer. (A) Isolerende CBE -mekanoforer forbundet med π -systemer, designet til at omarrangere til kontinuerligt forlænget konjugering under kraft. (B) -
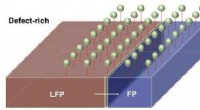 Forskere viser punktdefekter i katodekrystaller kan fremskynde lithiumabsorptionEn illustration viser et batteris katode, der gennemgår faseovergang fra jernfosfat (FP) til lithiumjernfosfat (LFP) under opladning. Simuleringer fra Rice University-forskere viste, at tilføjelse af
Forskere viser punktdefekter i katodekrystaller kan fremskynde lithiumabsorptionEn illustration viser et batteris katode, der gennemgår faseovergang fra jernfosfat (FP) til lithiumjernfosfat (LFP) under opladning. Simuleringer fra Rice University-forskere viste, at tilføjelse af
- Forskel mellem centimeter og målere
- Hvordan fytokemisk diversitet påvirker planteædende skader i et tropisk træsamfund
- Ny Spectre-cybertrussel unddrager sig patches
- Hvordan man udformer politikker, der understøtter både akvakultur og småskala fiskeri
- Hvad er nitrogenoxiderne?
- Trykte termoplasmoniske varmemønstre til behandling af neurologiske lidelser


