En blanding af 0,220 mol CO 0,350 H2 og 0,640 Han har et samlet tryk på 2,95 Atm hvad er H2?
En gass partialtryk er det tryk, som gassen ville udøve, hvis det var den eneste gas, der var til stede i beholderen.
En gass partialtryk kan beregnes ved hjælp af følgende formel:
$$P_i=P_T\cdot X_i$$
Hvor:
* $$P_i$$ er gassens partialtryk i atm,
* $$P_T$$ er det samlede tryk af blandingen i atm,
* $$X_i$$ er molfraktionen af gassen i blandingen.
Molfraktionen af en gas er forholdet mellem antallet af mol af den gas og det samlede antal mol gas i blandingen.
I denne opgave har vi en blanding af 0,220 mol CO, 0,350 mol H2 og 0,640 mol He med et samlet tryk på 2,95 atm.
Vi kan beregne molfraktionen af H2 ved hjælp af følgende formel:
$$X_{H_2}=\frac{0.350\text{ mol}}{0.220\text{ mol}+0.350\text{ mol}+0.640\text{ mol}}=0.259$$
Vi kan derefter bruge molfraktionen af H2 til at beregne partialtrykket af H2 ved hjælp af følgende formel:
$$P_{H_2}=2.95\text{atm}\times0.259=\boxed{0.765\text{atm}}$$
Derfor er partialtrykket af H2 i blandingen 0,765 atm.
 Varme artikler
Varme artikler
-
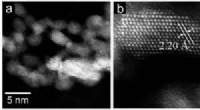 En rutheniumbaseret katalysator med højaktiv, flade overflader overgår metalbaserede konkurrenterAnalyse ved hjælp af højvinklet ringformet mørkfelt-scanningstransmissionselektronmikroskopi (HAADF-STEM) afslørede:(a) små og flade ruthenium-pletter over et stort domæne og (b) gitterafstanden svare
En rutheniumbaseret katalysator med højaktiv, flade overflader overgår metalbaserede konkurrenterAnalyse ved hjælp af højvinklet ringformet mørkfelt-scanningstransmissionselektronmikroskopi (HAADF-STEM) afslørede:(a) små og flade ruthenium-pletter over et stort domæne og (b) gitterafstanden svare -
 Elektro-sprayede mikrodråber hjælper med at dræbe bakterier og viraFigur 1. Polymer mikrodysearray. Kredit:Korea Advanced Institute of Science and Technology (KAIST) Med COVID-19 raser rundt om i verden, forskere fordobler metoder til at udvikle forskellige antim
Elektro-sprayede mikrodråber hjælper med at dræbe bakterier og viraFigur 1. Polymer mikrodysearray. Kredit:Korea Advanced Institute of Science and Technology (KAIST) Med COVID-19 raser rundt om i verden, forskere fordobler metoder til at udvikle forskellige antim -
 Forskere opdager, hvordan proteiner danner krystaller, der beklæder en mikrobes skalDet er en to-trins proces, der fremskynder krystallisering. Kredit:Greg Stewart/SLAC National Accelerator Laboratory, J. Herrmann et al./PNAS Mange mikrober bærer smukt mønstrede krystallinske ska
Forskere opdager, hvordan proteiner danner krystaller, der beklæder en mikrobes skalDet er en to-trins proces, der fremskynder krystallisering. Kredit:Greg Stewart/SLAC National Accelerator Laboratory, J. Herrmann et al./PNAS Mange mikrober bærer smukt mønstrede krystallinske ska -
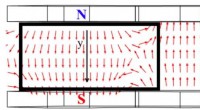 Magnetfelters indflydelse på tyndfilmstrukturerVisualisering af et magnetfelt mellem permanente magneter ved placeringen af substratet til aflejring af NiFe/IrMn film tyndfilmstruktur. Kredit:Valeria Rodionova Et team af forskere fra Immanue
Magnetfelters indflydelse på tyndfilmstrukturerVisualisering af et magnetfelt mellem permanente magneter ved placeringen af substratet til aflejring af NiFe/IrMn film tyndfilmstruktur. Kredit:Valeria Rodionova Et team af forskere fra Immanue
- Mod højkvalitets zinkoxid kvanteprikker til biomedicinske applikationer
- James Webb Telescope for at frigive flere betagende kosmiske udsigter
- Nye koncepter til styring af sonderende rovere
- Hvad er hver af ledningerne på brugspolepolerne?
- Brug sociale medier til at tage fat på klimaforandringer
- Hvor mange mol er der i 2,3 x 1023 formelenheder af NaCl?


