Hvad sker der, når en væske når kogepunktet?
Her er hvad der sker, når en væske når sit kogepunkt:
- Ved den givne temperatur og tryk er væsken og dens damp i ligevægt, hvilket betyder, at de begge kan eksistere side om side.
- Der dannes dampbobler inde i væsken på grund af hurtig fordampning. Disse bobler, der består af væskens damptilstand, vokser sig større og stiger til overfladen.
- På væskens overflade brister de ekspanderende dampbobler og frigiver damp til atmosfæren. Denne frigivelse af damp skaber udseendet af kogning og boblende.
- Efterhånden som der frigives mere damp, dannes og stiger flere bobler, som kontinuerligt producerer damp eller damp.
Det er vigtigt at bemærke, at en væskes kogepunkt afhænger af flere faktorer, herunder atmosfærisk tryk, højde og urenheder i væsken. Generelt koger en væske ved en højere temperatur, da det omgivende tryk stiger, og lavere tryk fører til lavere kogepunkter.
Sidste artikelHvorfor bruges metan til bunsenbrændere?
Næste artikelEt neutralt atom, der har 8 protoner skal have?
 Varme artikler
Varme artikler
-
 Kemikere udvikler en bioinspireret strategi til kontrolleret syntese af polyenerLysdrevet flip af alkengeometri. Kredit:Ryan Gilmour De forekommer i naturen, er reaktive og spiller en rolle i mange biologiske processer:polyener. Det er ikke underligt, at kemikere i lang tid h
Kemikere udvikler en bioinspireret strategi til kontrolleret syntese af polyenerLysdrevet flip af alkengeometri. Kredit:Ryan Gilmour De forekommer i naturen, er reaktive og spiller en rolle i mange biologiske processer:polyener. Det er ikke underligt, at kemikere i lang tid h -
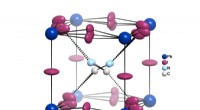 Perovskite solceller:Mulige aspekter af høj effektivitet afdækketTegningen illustrerer vekselvirkningen af den organiske methylammoniumkation (CH3NH3+) med de omgivende iodidioner. Skiftet af iodidatomerne ud af det fælles plan med bly forårsager brud på inversio
Perovskite solceller:Mulige aspekter af høj effektivitet afdækketTegningen illustrerer vekselvirkningen af den organiske methylammoniumkation (CH3NH3+) med de omgivende iodidioner. Skiftet af iodidatomerne ud af det fælles plan med bly forårsager brud på inversio -
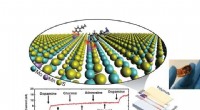 Meget følsom dopamindetektor bruger 2-D materialerSkematisk af en meget selektiv dopamindetektor ved brug af todimensionelt materiale. Kredit:Derrick Butler, Penn State En superfølsom dopamindetektor kan hjælpe med tidlig diagnosticering af flere
Meget følsom dopamindetektor bruger 2-D materialerSkematisk af en meget selektiv dopamindetektor ved brug af todimensionelt materiale. Kredit:Derrick Butler, Penn State En superfølsom dopamindetektor kan hjælpe med tidlig diagnosticering af flere -
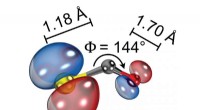 Bestemmelse af strukturen af et molekyle med laserinduceret elektrondiffraktionSkematisk illustration af den molekylære struktur af ioniseret carbonylsulfid (OCS + ) viser dens bøjede og asymmetriske konfiguration og bindingslængderne mellem atomer. Kredit:ICFO Lysmikrosko
Bestemmelse af strukturen af et molekyle med laserinduceret elektrondiffraktionSkematisk illustration af den molekylære struktur af ioniseret carbonylsulfid (OCS + ) viser dens bøjede og asymmetriske konfiguration og bindingslængderne mellem atomer. Kredit:ICFO Lysmikrosko
- Honolulus borgmester nedlægger veto mod lovforslaget om at begrænse Uber, Lyft surge takster
- Massivt asteroideemne med nye fund
- Drivhusgas genbrugt i nye eksperimenter
- Mars var våd, men varm?
- Fosforen nanobånd lever op til hypen i første demonstration
- Transport af vand ind i den dybe Jord af Al-fase D


