Hvorfor er C-CL-bindingslængden kortere i vinylchlorid end ethylchlorid?
I vinylchlorid er carbonatomet bundet til chloratomet (C1) sp2 hybridiseret på grund af tilstedeværelsen af dobbeltbindingen. sp2 hybridisering involverer blanding af en s orbitaler og to p orbitaler, hvilket resulterer i tre ækvivalente hybrid orbitaler arrangeret i en trigonal plan geometri. Disse hybridorbitaler danner stærke sigma-bindinger med de tilstødende atomer, herunder chloratomet.
På den anden side, i ethylchlorid, er carbonatomet bundet til chloratomet (C1) sp3 hybridiseret. sp3 hybridisering involverer blanding af en s orbital og tre p orbitaler, hvilket resulterer i fire ækvivalente hybrid orbitaler arrangeret i en tetraedrisk geometri. Disse hybridorbitaler danner også sigma-bindinger med de tilstødende atomer, herunder chloratomet.
Forskellen i hybridisering mellem carbonatomerne påvirker C-Cl-bindingslængden. I vinylchlorid har det sp2 hybridiserede carbonatom en mere koncentreret elektrontæthed i det område, hvor bindingen dannes sammenlignet med det sp3 hybridiserede carbonatom i ethylchlorid. Denne øgede elektrontæthed fører til stærkere elektrostatisk tiltrækning mellem carbon- og kloratomerne, hvilket resulterer i en kortere C-Cl-bindingslængde i vinylchlorid.
Derudover bidrager tilstedeværelsen af dobbeltbindingen i vinylchlorid til afkortningen af C-Cl-bindingen. Dobbeltbindingen trækker elektrontætheden fra C-Cl-bindingen, hvilket gør chloratomet mere elektronegativt og øger dets tiltrækning mod carbonatomet. Dette styrker C-Cl-bindingen yderligere og bidrager til dens kortere længde.
Sammenfattende er den kortere C-Cl-bindingslængde i vinylchlorid sammenlignet med ethylchlorid en konsekvens af sp2-hybridisering af carbonatomet, øget elektrondensitet og dobbeltbindingens elektrontiltrækkende effekt.
Sidste artikelHvorfor vil et stof lede, når det er smeltet, men ikke fast?
Næste artikelHvad er bindingsrækkefølgen for He2?
 Varme artikler
Varme artikler
-
 Molekyle flyvehastighed til påvisning af stofferKredit:CC0 Public Domain Tilstedeværelsen af cannabinoider i tekstilvarer og farmakologiske varer og behovet for at skelne dem fra dem, der findes i stoffer og psykotrope midler, har ført til ud
Molekyle flyvehastighed til påvisning af stofferKredit:CC0 Public Domain Tilstedeværelsen af cannabinoider i tekstilvarer og farmakologiske varer og behovet for at skelne dem fra dem, der findes i stoffer og psykotrope midler, har ført til ud -
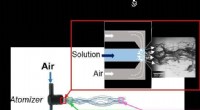 Forskere producerer filamenter og fibre tre gange finere end et menneskehårBeskrivelse af produktionen af PEG-fibre med de Flow Blurring-forstøvere, der blev brugt i undersøgelsen. Kredit:University of Sevilla En gruppe forskere fra Higher Technical School of Engineeri
Forskere producerer filamenter og fibre tre gange finere end et menneskehårBeskrivelse af produktionen af PEG-fibre med de Flow Blurring-forstøvere, der blev brugt i undersøgelsen. Kredit:University of Sevilla En gruppe forskere fra Higher Technical School of Engineeri -
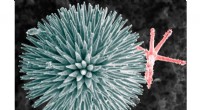 Nærmere kig afslører aksiale filamenter i havsvampspikler, der består af proteinerElektronmikroskopibillede af glasspikler fra svampen Geodia cydonium. Kredit:Zlotnikov Group, B TERNING, TU Dresden Et team af forskere med medlemmer fra Frankrig, Tyskland og Israel har fundet ud
Nærmere kig afslører aksiale filamenter i havsvampspikler, der består af proteinerElektronmikroskopibillede af glasspikler fra svampen Geodia cydonium. Kredit:Zlotnikov Group, B TERNING, TU Dresden Et team af forskere med medlemmer fra Frankrig, Tyskland og Israel har fundet ud -
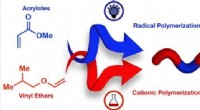 Designer polymerer efter behovKredit:American Chemical Society Når juvelerer laver en halskæde, de styrer rækkefølgen og antallet af hver perle eller juvel, de bruger til at danne et ønsket mønster. Det har været udfordrende f
Designer polymerer efter behovKredit:American Chemical Society Når juvelerer laver en halskæde, de styrer rækkefølgen og antallet af hver perle eller juvel, de bruger til at danne et ønsket mønster. Det har været udfordrende f
- Sådan sletter eller deaktiverer du din Instagram-konto
- Forskere guider en enkelt ion gennem et Bose-Einstein-kondensat
- Forskere udvikler en 15-minutters test til at vurdere immunrespons
- Sådan finder du antallet af neutroner, protoner og elektroner til atomer, joner og isotoper
- JPL-missionen slår rekord for den mindste satellit til at opdage en exoplanet
- Forudsigelse af menneskelig bevægelse under katastrofer kunne give mulighed for mere effektiv nødb…


