Hvorfor vil et stof lede, når det er smeltet, men ikke fast?
Men når et stof smeltes, svækkes eller brydes de intermolekylære kræfter, og partiklerne bliver lettere frie til at bevæge sig. Dette gør det muligt for partiklerne at bære elektrisk ladning, hvorfor smeltede stoffer kan lede elektricitet.
For eksempel er natriumchlorid (NaCl) et fast stof ved stuetemperatur og leder ikke elektricitet. Men når natriumchlorid smeltes, er ionerne (Na+ og Cl-) frie til at bevæge sig og bære elektrisk ladning, hvilket tillader det smeltede stof at lede elektricitet.
Sammenfattende skyldes forskellen i ledningsevne mellem faste og smeltede stoffer partiklernes mobilitet. I et fast stof er partiklerne fikseret på plads og kan ikke bevæge sig frit, hvilket forhindrer strømmen af elektrisk ladning. I et smeltet stof er partiklerne frie til at bevæge sig, hvilket giver dem mulighed for at bære elektrisk ladning og lede elektricitet.
 Varme artikler
Varme artikler
-
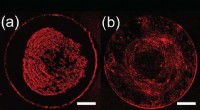 Ny fremstillingsteknik kan forbedre det almindelige problem inden for printteknologiFor figur A, der er partikeltransport til spidsen af måldråben, og der dannes en tæt midteraflejring. For figur B, den endelige kortlagte indbetaling er mere ensartet. Kredit: Langmuir En ny fr
Ny fremstillingsteknik kan forbedre det almindelige problem inden for printteknologiFor figur A, der er partikeltransport til spidsen af måldråben, og der dannes en tæt midteraflejring. For figur B, den endelige kortlagte indbetaling er mere ensartet. Kredit: Langmuir En ny fr -
 Overraskende stærk og deformerbar siliciumEt par mikrometer siliciumsøjler under elektronmikroskopet:Sådanne strukturer gør materialet mere elastisk. Kredit:Laszlo Pethö / Empa Forskere ved ETH og Empa har vist, at små genstande kan laves
Overraskende stærk og deformerbar siliciumEt par mikrometer siliciumsøjler under elektronmikroskopet:Sådanne strukturer gør materialet mere elastisk. Kredit:Laszlo Pethö / Empa Forskere ved ETH og Empa har vist, at små genstande kan laves -
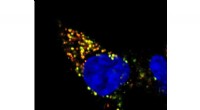 Sortering og udskillelse af insulin efter udløbsdatoForskere tog dette billede af en insulin-udskillende celle fra en mus ved hjælp af en teknik til at mærke insulin granulat, efter alder. I yngre granulater, markøren udsender et grønt fluorescerende l
Sortering og udskillelse af insulin efter udløbsdatoForskere tog dette billede af en insulin-udskillende celle fra en mus ved hjælp af en teknik til at mærke insulin granulat, efter alder. I yngre granulater, markøren udsender et grønt fluorescerende l -
 Ny, holdbar katalysator til nøglebrændstofcellereaktion kan vise sig nyttig i miljøvenlige køret…En faktor, der holder den udbredte brug af miljøvenlige brintbrændselsceller tilbage i biler, lastbiler og andre køretøjer er prisen for de platinkatalysatorer, der får cellerne til at fungere. En til
Ny, holdbar katalysator til nøglebrændstofcellereaktion kan vise sig nyttig i miljøvenlige køret…En faktor, der holder den udbredte brug af miljøvenlige brintbrændselsceller tilbage i biler, lastbiler og andre køretøjer er prisen for de platinkatalysatorer, der får cellerne til at fungere. En til
- Fremskridt i nanostørrelse mod næste store behandlingsæra inden for tandpleje
- Den maksimale masse af ikke-roterende neutronstjerne udledes præcist til at være 2,25 solmasser
- Plastaffald dækker mellemamerikanske floder, søer og strande
- At overdrive, hvor meget kuldioxid der kan optages ved træplantning, risikerer at afskrække afgør…
- Sådan holder du fugle væk fra Hummingbird Feeder
- Den geologiske registrering af mudderaflejringer


