Hvordan forbereder du 1,25 procent H2SO4-opløsningen?
1. Beregn den nødvendige mængde koncentreret H2SO4
Bestem mængden af koncentreret H2SO4 (18,4 M), der kræves for at fremstille 1 L af den 1,25 % H2SO4-opløsning.
M1V1 =M2V2,
hvor M1 og V1 repræsenterer molariteten og volumenet af det koncentrerede H2SO4, M2 er den ønskede molaritet (1,25%), og V2 er opløsningens slutvolumen (1 L).
Hvis vi omarrangerer formlen for at løse for V1, får vi:
V1 =(M2 x V2) / M1
Udskiftning af værdierne:
V1 =(0,0125 mol/L x 1 L) / 18,4 mol/L =0,0006842 L eller 0,6842 mL
Derfor skal du bruge ca. 0,6842 mL koncentreret H2SO4 for at fremstille 1 L 1,25 % H2SO4-opløsning.
2. Forbered løsningen
- Bær passende sikkerhedsudstyr, såsom handsker og øjenværn.
- Tilsæt langsomt det beregnede volumen af koncentreret H2SO4 (0,6842 ml) til et lille bægerglas indeholdende nogle få milliliter destilleret vand.
- Rør forsigtigt bægerglasset rundt for at blande syren og vandet.
- Overfør den fortyndede syreopløsning til en 1 L målekolbe.
- Skyl bægerglasset med en lille mængde destilleret vand, og overfør skylningerne til målekolben.
- Tilsæt mere destilleret vand til kolben, indtil opløsningen når 1 L-mærket.
- Bland opløsningen grundigt ved at dreje kolben.
Din 1,25 % H2SO4-opløsning er nu klar til brug.
Bemærk: Håndter altid koncentreret svovlsyre med ekstrem forsigtighed, da det er et stærkt ætsende stof. Tilsæt altid langsomt syre til vandet, aldrig omvendt, for at undgå kraftige reaktioner.
 Varme artikler
Varme artikler
-
 Hydrogelcoating er den første til at forhindre isdannelse på 3 forskellige måderBelægningen kunne være en billig løsning til at forhindre udendørs rør, flyvingekomponenter og andet udstyr fra at fryse i kolde temperaturer. Kredit:iStock.com/fotograff Materialeforskere ved UCL
Hydrogelcoating er den første til at forhindre isdannelse på 3 forskellige måderBelægningen kunne være en billig løsning til at forhindre udendørs rør, flyvingekomponenter og andet udstyr fra at fryse i kolde temperaturer. Kredit:iStock.com/fotograff Materialeforskere ved UCL -
 Flere elektroniske materialer åbnede op med nye metal-organiske rammerProfessor Richard Walton, University of Warwick. Kredit:University of Warwick Flere materialer til elektroniske applikationer kunne identificeres, takket være opdagelsen af en ny metal-organisk
Flere elektroniske materialer åbnede op med nye metal-organiske rammerProfessor Richard Walton, University of Warwick. Kredit:University of Warwick Flere materialer til elektroniske applikationer kunne identificeres, takket være opdagelsen af en ny metal-organisk -
 Fremstilling af brintlagermaterialer fra industriaffaldKredit:Pixabay/CC0 Public Domain Uanset om det er biler, energi eller mobiltelefoner, er det moderne samfund bygget på metaller, og vores fremtid afhænger også stærkt af disse materialer. At opbeva
Fremstilling af brintlagermaterialer fra industriaffaldKredit:Pixabay/CC0 Public Domain Uanset om det er biler, energi eller mobiltelefoner, er det moderne samfund bygget på metaller, og vores fremtid afhænger også stærkt af disse materialer. At opbeva -
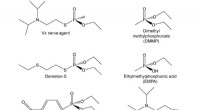 Protein, der kunne forhindre kemisk krigsangreb oprettetVX-nervegiften, dens simulanter og nedbrydningsprodukter. VX ligner kemisk både almindelige organofosfater, der bruges som insekticider (venstre) (midten og nederst) og dens stadig giftige nedbrydning
Protein, der kunne forhindre kemisk krigsangreb oprettetVX-nervegiften, dens simulanter og nedbrydningsprodukter. VX ligner kemisk både almindelige organofosfater, der bruges som insekticider (venstre) (midten og nederst) og dens stadig giftige nedbrydning
- NASAs Hi-C lancerer for at undersøge solens corona
- Hvordan COVID muliggjorde nye former for økonomisk misbrug af kvinder i Indien
- Hvordan fremstilles plader?
- Hvad er en bet ionisk ligning?
- Professor arbejder på at udvikle strømkilder til fleksible, strækbar elektronik
- I reaktionen MgCl2 plus 2KOH og 65532 Mg(OH)2 2KCl hvor mange mol KOH reagerer med 1 mol MgCl2?


