Hvordan adskiller natriumchlorids egenskaber sig fra 2 grundstoffer, der udgør det?
Natrium :Natrium er et blødt, sølvhvidt metal, der er meget reaktivt. Det er det sjette mest udbredte grundstof i jordskorpen. Natrium er så reaktivt, at det skal opbevares i et tørt miljø, fordi det reagerer med vand og danner natriumhydroxid (NaOH) og brintgas (H2). Natrium er også en meget god leder af elektricitet og varme.
Klor :Klor er en grønlig-gul gas, der også er meget reaktiv. Det er det næststørste grundstof i jordskorpen. Klor bruges i en række forskellige anvendelser, herunder vandrensning, blegning og produktion af PVC-rør. Klor er også en meget giftig gas, og kan forårsage åndedrætsproblemer, hvis det indåndes.
Natriumchlorid :Natriumchlorid, også kendt som bordsalt, er en hvid, krystallinsk forbindelse, der dannes, når natrium- og kloratomer reagerer med hinanden. Natriumchlorid er en ionisk forbindelse, hvilket betyder, at natriumatomerne mister en elektron til kloratomerne, hvilket resulterer i en positiv natriumion (Na+) og en negativ chloridion (Cl-). Disse ioner tiltrækkes derefter til hinanden og danner en stabil krystalgitterstruktur.
Natriumklorid er et meget anderledes stof end enten natrium eller klor. Det er et hårdt, sprødt fast stof, der ikke er særlig reaktivt. Natriumchlorid er opløseligt i vand, og dets opløsning leder elektricitet. Natriumchlorid er også et vigtigt næringsstof for mennesker og mange andre dyr.
Natriumchlorids forskellige egenskaber skyldes den måde, hvorpå natrium- og kloratomerne er bundet sammen. I natriumchlorid er atomerne bundet sammen af ionbindinger, som er meget stærke. Dette er grunden til, at natriumchlorid er et hårdt, sprødt fast stof, der ikke er særlig reaktivt. I modsætning hertil er natrium- og kloratomerne i natrium og klorgas bundet sammen af kovalente bindinger, som er svagere. Dette er grunden til, at natrium og klorgas begge er bløde, reaktive stoffer.
Natriumchlorids egenskaber er også forskellige fra egenskaberne af dets bestanddele på grund af den måde, hvorpå ionerne er arrangeret i krystalgitterstrukturen. I natriumchlorid er ionerne arrangeret i et regelmæssigt, gentaget mønster. Det er det, der giver natriumchlorid sin karakteristiske kubiske form. Det regelmæssige arrangement af ionerne gør også natriumchlorid til en meget god leder af elektricitet.
Sidste artikelHvordan afgør du, om regn er sur?
Næste artikelHvordan påvirker honning bagepulver?
 Varme artikler
Varme artikler
-
 Enkeltpartikelundersøgelser peger vejen mod næste generation af lysskærmeKredit:University of Tsukuba Holografiske skærme hjælper med at tilføje en tredimensionel – og dermed mere naturtro – følelse til det, der ellers ville fremstå som et todimensionelt billede. Nu, f
Enkeltpartikelundersøgelser peger vejen mod næste generation af lysskærmeKredit:University of Tsukuba Holografiske skærme hjælper med at tilføje en tredimensionel – og dermed mere naturtro – følelse til det, der ellers ville fremstå som et todimensionelt billede. Nu, f -
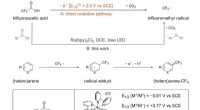 Trifluoreddikesyre virker som trifluormethyleringsmiddel i aren CH-funktionaliseringTrifluormethylering, Chlorodifluormethylering og Perfluoralkylering af Arenes. Kredit:JIN Jian Forskere ved Shanghai Institute of Organic Chemistry fra det kinesiske videnskabsakademi har udviklet
Trifluoreddikesyre virker som trifluormethyleringsmiddel i aren CH-funktionaliseringTrifluormethylering, Chlorodifluormethylering og Perfluoralkylering af Arenes. Kredit:JIN Jian Forskere ved Shanghai Institute of Organic Chemistry fra det kinesiske videnskabsakademi har udviklet -
 Et revolutionerende materiale til rumfart og neuromorfisk databehandlingVanadium Dioxide chip udviklet på EPFLs NANOLAB. Kredit:EPFL / Jamani Caillet Først kom omskifteren. Derefter transistoren. Nu står en anden innovation for at revolutionere den måde, vi styrer ele
Et revolutionerende materiale til rumfart og neuromorfisk databehandlingVanadium Dioxide chip udviklet på EPFLs NANOLAB. Kredit:EPFL / Jamani Caillet Først kom omskifteren. Derefter transistoren. Nu står en anden innovation for at revolutionere den måde, vi styrer ele -
 Ny metode åbner vejen for skærende værktøjer med længere levetidKostas Sarakinos, Davide Sangiovanni og Georgio Almyras. Kredit:Anna Nilsen Forskere ved Linköpings Universitet, LiU, har udviklet en teoretisk model, der muliggør simuleringer for at vise, hvad d
Ny metode åbner vejen for skærende værktøjer med længere levetidKostas Sarakinos, Davide Sangiovanni og Georgio Almyras. Kredit:Anna Nilsen Forskere ved Linköpings Universitet, LiU, har udviklet en teoretisk model, der muliggør simuleringer for at vise, hvad d


