Hvad er formen og bindingsvinklen for NOCl?
Formen af NOCl beskrives bedst som en trigonal pyramide. Molekylet har tre atomer bundet til nitrogenatomet, hvilket skaber en tetraedrisk elektronpargeometri. Et af disse elektronpar er dog et ensomt par, som skubber de tre andre atomer tættere på hinanden og skaber en pyramideformet form.
Bindningsvinkel for NOCl
Bindingsvinklen for NOCl er cirka 107 grader. Dette er lidt mindre end den ideelle tetraedriske bindingsvinkel på 109,5 grader på grund af tilstedeværelsen af det enlige elektronpar på nitrogenatomet. Det enlige elektronpar optager en betydelig mængde plads, og skubber de tre bundne atomer tættere sammen og får bindingsvinklerne til at falde.
Her er en visualisering af formen og bindingsvinklen for NOCl:
[Billede af en trigonal pyramide med et ensomt elektronpar på nitrogenatomet]
De tre atomer, der er bundet til nitrogenatomet (ilt, klor og det andet klor) er arrangeret i en trekantet pyramideform, hvor det enlige elektronpar optager det fjerde hjørne. Bindingsvinklerne mellem nitrogenet og de tre bundne atomer er cirka 107 grader.
Sidste artikelHvad er sammensat forbindelse?
Næste artikelEr svovldioxid en syrebase eller neutral?
 Varme artikler
Varme artikler
-
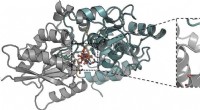 Sultende tuberkulose af sukkerarter kan være en ny måde at bekæmpe det påDetaljer på molekylært niveau af interaktionen af trehalose bundet til den mykobakterielle LpqY-transporter. Kredit:University of Warwick Tuberkulose er en ødelæggende sygdom, der kræver over 1,
Sultende tuberkulose af sukkerarter kan være en ny måde at bekæmpe det påDetaljer på molekylært niveau af interaktionen af trehalose bundet til den mykobakterielle LpqY-transporter. Kredit:University of Warwick Tuberkulose er en ødelæggende sygdom, der kræver over 1, -
 Forskerteam udvikler en ny klasse bløde materialerShifeng Nian og ph.d. studerende Jinchang Zhu ilægger blækket i en sprøjte til 3D -print. Kredit:University of Virginia Jeg tror, du er stille. Dette var den mest brugte sætning i 2020, ifølge H
Forskerteam udvikler en ny klasse bløde materialerShifeng Nian og ph.d. studerende Jinchang Zhu ilægger blækket i en sprøjte til 3D -print. Kredit:University of Virginia Jeg tror, du er stille. Dette var den mest brugte sætning i 2020, ifølge H -
 Nye materialer:Strålende hvid uden pigmenterEn nanostruktureret polymerfilm modelleret efter den hvide bille Cyphochilus insulanus producerer en strålende hvid belægning. Kredit:Julia Syurik, KIT Polymerfolier, der er ekstremt tynde og kend
Nye materialer:Strålende hvid uden pigmenterEn nanostruktureret polymerfilm modelleret efter den hvide bille Cyphochilus insulanus producerer en strålende hvid belægning. Kredit:Julia Syurik, KIT Polymerfolier, der er ekstremt tynde og kend -
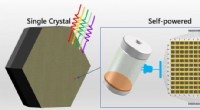 Multi-tommer enkelt-krystallinsk perovskit til selvforsynet integreret kredsløb fotodetektion rappo…Tommerstørrelse perovskit-enkeltkrystaller af høj kvalitet dannet ved at undertrykke faseadskillelsen til applikationer i lysdrevne integrerede kredsløb. Kredit:DICP Perovskitter med flere katione
Multi-tommer enkelt-krystallinsk perovskit til selvforsynet integreret kredsløb fotodetektion rappo…Tommerstørrelse perovskit-enkeltkrystaller af høj kvalitet dannet ved at undertrykke faseadskillelsen til applikationer i lysdrevne integrerede kredsløb. Kredit:DICP Perovskitter med flere katione


