Hvorfor danner metaller undtagen Mg og Mn ikke brint, når de reagerer med salpetersyre?
Reaktionen mellem et metal og salpetersyre kan repræsenteres ved følgende generelle ligning:
$$Metal + HNO_3 → Metalnitrat + Vand + Nitrogenoxider$$
I denne reaktion oxideres metalatomerne af nitrationerne (NO3-) i salpetersyre til dannelse af metalioner (M+). Nitrationerne reduceres til nitrogenoxider, såsom nitrogenoxid (NO) og nitrogendioxid (NO2). Hydrogenatomerne i salpetersyre frigives ikke som brintgas, men i stedet kombineres de med oxygenatomer og danner vandmolekyler.
Magnesium og mangan er to undtagelser fra denne generelle regel. De reagerer med salpetersyre og danner brintgas, fordi de lettere oxideres end de fleste andre metaller. Reaktionerne mellem magnesium og mangan med salpetersyre kan repræsenteres ved følgende ligninger:
$$Mg + 2HNO_3 → Mg(NO_3)_2 + H_2$$
$$Mn + 2HNO_3 → Mn(NO_3)_2 + H_2$$
I disse reaktioner oxideres magnesium- og manganatomerne af nitrationerne til dannelse af henholdsvis magnesium- og manganioner (Mg2+ og Mn2+). Hydrogenatomerne i salpetersyre frigives som brintgas.
Sidste artikelHvad er princippet om to blandinger?
Næste artikelHvad er sammensætningen af eddikesyre?
 Varme artikler
Varme artikler
-
 Forskere identificerer oprindelsen af metabolismeLivet kan være opstået i nærheden af hydrotermiske ventilationsåbninger rige på jern og svovl. De tidligste celler inkorporerede disse elementer i små peptider, som blev de første og enkleste ferred
Forskere identificerer oprindelsen af metabolismeLivet kan være opstået i nærheden af hydrotermiske ventilationsåbninger rige på jern og svovl. De tidligste celler inkorporerede disse elementer i små peptider, som blev de første og enkleste ferred -
 Kombinerer sollys og spildevandsnitrat for at gøre verdens nummer 2 kemikalieUIC-forskere skaber et bæredygtigt elektrokemisk system, hvor en solcelle er knyttet til en brønd, der indeholder en flydende opløsning. Når opladet, nitrater fra spildevand i den flydende opløsning o
Kombinerer sollys og spildevandsnitrat for at gøre verdens nummer 2 kemikalieUIC-forskere skaber et bæredygtigt elektrokemisk system, hvor en solcelle er knyttet til en brønd, der indeholder en flydende opløsning. Når opladet, nitrater fra spildevand i den flydende opløsning o -
 Hvor tydeligere rapportering af negative eksperimentelle resultater ville forbedre reaktionsplanlæg…Kredit:Angewandte Chemie Databaser indeholdende enorme mængder eksperimentelle data er tilgængelige for forskere på tværs af en lang række kemiske discipliner. Et team af forskere har imidlertid op
Hvor tydeligere rapportering af negative eksperimentelle resultater ville forbedre reaktionsplanlæg…Kredit:Angewandte Chemie Databaser indeholdende enorme mængder eksperimentelle data er tilgængelige for forskere på tværs af en lang række kemiske discipliner. Et team af forskere har imidlertid op -
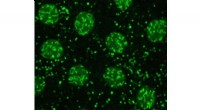 Lipiddråber spiller afgørende roller ud over fedtopbevaringForskerne brugte avanceret fluorescensmikroskopi til at se lipiddråber i frugtflueembryoner. Her, H2Av (fluoresceret i grønt) er til stede i cellens kerner (de store klatter) og på lipiddråber (de min
Lipiddråber spiller afgørende roller ud over fedtopbevaringForskerne brugte avanceret fluorescensmikroskopi til at se lipiddråber i frugtflueembryoner. Her, H2Av (fluoresceret i grønt) er til stede i cellens kerner (de store klatter) og på lipiddråber (de min
- Tonehøjde perfekt:Sådan identificerer gøglerkener andre arters alarmopkald
- Styring mod kvantesimulering i skala
- Hvilken type binding forekommer i Zncl2?
- Skyundersøgelse afmystificerer virkningen af aerosoler
- Producerer praktiske geler fra et protein, der findes i menneskeblod
- Sådan læser du den periodiske tabel for Kids


