Forskere identificerer oprindelsen af metabolisme
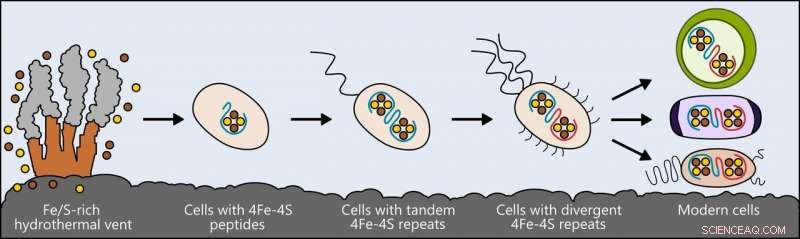
Livet kan være opstået i nærheden af hydrotermiske ventilationsåbninger rige på jern og svovl. De tidligste celler inkorporerede disse elementer i små peptider, som blev de første og enkleste ferredoxiner - proteiner, der sender elektroner inden i cellen, at støtte stofskiftet. Efterhånden som cellerne udviklede sig, ferredoxiner muterede til mere komplekse former. Ferredoxinerne i moderne bakterier, plante- og dyreceller er alle afledt af den simple forfader. Kredit:Ian Campbell, Rice University
En Rutgers-ledet undersøgelse kaster lys over et af videnskabens mest varige mysterier:Hvordan begyndte stofskiftet-den proces, hvor livet driver sig selv ved at omdanne energi fra mad til bevægelse og vækst-?
For at besvare det spørgsmål, forskerne omkonstruerede et urprotein og indsatte det i en levende bakterie, hvor det med succes drev cellens metabolisme, vækst og reproduktion, ifølge undersøgelsen i Procedurer fra National Academy of Sciences .
"Vi er tættere på at forstå den indre funktion af den gamle celle, der var forfader til alt liv på jorden - og, derfor, at forstå, hvordan livet opstod i første omgang, og de veje, livet måske har taget andre verdener, "sagde hovedforfatter Andrew Mutter, en postdoktor ved Rutgers Universitets Institut for Hav- og Kystvidenskab.
Opdagelsen har også konsekvenser for syntetisk biologi, som udnytter metabolismen af mikrober til fremstilling af industrikemikalier; og bioelektronik, som søger at anvende cellers naturlige kredsløb til energilagring og andre funktioner.
Forskerne kiggede på en klasse proteiner kaldet ferredoxiner, som understøtter metabolisme i bakterier, planter og dyr ved at flytte elektricitet gennem celler. Disse proteiner har forskellige, komplekse former i nutidens levende ting, men forskere spekulerer på, at de alle stammer fra et meget enklere protein, der var til stede i alt livets forfader.
På samme måde som biologer sammenligner moderne fugle og krybdyr for at drage konklusioner om deres fælles forfader, forskerne sammenlignede ferredoxin -molekyler, der er til stede i levende ting, og ved hjælp af computermodeller, designet forfædres former, der kan have eksisteret på et tidligere stadium i livets udvikling.
Denne forskning førte til deres oprettelse af en grundlæggende version af proteinet - et simpelt ferredoxin, der er i stand til at lede elektricitet i en celle, og at, i evigheder af evolution, kunne have givet anledning til de mange typer, der findes i dag.
Derefter, at bevise deres model af det gamle protein faktisk kunne understøtte livet, de indsatte det i en levende celle. De tog genomet af E. coli -bakterier, fjernet det gen, det bruger til at skabe ferredoxin i naturen, og splejset i et gen for deres reverse-manipulerede protein. Den modificerede E. coli -koloni overlevede og voksede, dog langsommere end normalt.
Undersøg medforfatter Vikas Nanda, professor ved Rutgers Robert Wood Johnson Medical School og Center for Advanced Biotechnology and Medicine, sagde opdagelsens konsekvenser for syntetisk biologi og bioelektronik stammer fra ferredoxins rolle i livets kredsløb.
"Disse proteiner kanaliserer elektricitet som en del af en celles interne kredsløb. Ferredoxinerne, der optræder i det moderne liv, er komplekse-men vi har skabt en strippet version, der stadig understøtter liv. Fremtidige eksperimenter kan bygge på denne enkle version til mulige industrielle applikationer , "Sagde Nanda.
 Varme artikler
Varme artikler
-
 Video:Hvordan hårfarve virkerKredit:The American Chemical Society Uanset om du har brug for en forklædning for at løbe fra loven eller bare prøver at efterligne *NSYNC-tidens frostede tip, du kan få brug for noget kemisk assi
Video:Hvordan hårfarve virkerKredit:The American Chemical Society Uanset om du har brug for en forklædning for at løbe fra loven eller bare prøver at efterligne *NSYNC-tidens frostede tip, du kan få brug for noget kemisk assi -
 En hurtig, letanvendelig DNA-amplifikationsmetode ved 37 CelciusEn DNA-streng (lilla) primer eksponentiel amplifikation af DNA (rød) som signaler til at dirigere lysemission af DNA-nanodevices. Kredit:Organisk og biomolekylær kemi Forskere i Japan har udviklet
En hurtig, letanvendelig DNA-amplifikationsmetode ved 37 CelciusEn DNA-streng (lilla) primer eksponentiel amplifikation af DNA (rød) som signaler til at dirigere lysemission af DNA-nanodevices. Kredit:Organisk og biomolekylær kemi Forskere i Japan har udviklet -
 Antistof mod kræftfremkaldende stof dechifreretNår fedt reagerer med glødende kul ved en grill, der dannes et stof, som kemikerne kalder benzopyren. Det er et udbredt miljøgift, der kan forårsage kræft hos mennesker. Kredit:Fotolia/Dederer Som
Antistof mod kræftfremkaldende stof dechifreretNår fedt reagerer med glødende kul ved en grill, der dannes et stof, som kemikerne kalder benzopyren. Det er et udbredt miljøgift, der kan forårsage kræft hos mennesker. Kredit:Fotolia/Dederer Som -
 Team udvikler maskine med det formål at stoppe tekstilaffaldFra venstre, Emelie Kamera ’17, Anil Netravali, Jean &Douglas McLean -professoren i fibervidenskab og beklædningsdesign, Tasha Lewis, assisterende professor i fibervidenskab og beklædningsdesign, og S
Team udvikler maskine med det formål at stoppe tekstilaffaldFra venstre, Emelie Kamera ’17, Anil Netravali, Jean &Douglas McLean -professoren i fibervidenskab og beklædningsdesign, Tasha Lewis, assisterende professor i fibervidenskab og beklædningsdesign, og S
- Fluorescerende polymer registrerer spor af eksplosive enheder
- Undersøgelse af de færdigheder, der er mest nødvendige for succes på dagens arbejdsplads
- Nye rammer kan hjælpe lærere med at tilpasse deres faglige læring
- Visning af atomstrukturer af dopingatomer i 3D relateret til elektrisk aktivitet i en halvleder
- Vikingeskibsbegravelser indhyllet i mystik
- Forsteningsprocessen af dinosaurer er tilbage


