Hvad sker der, når zink udsættes for ilt og vand?
Zn(s) + O2(g) + 2H2O(l) → Zn(OH)2(s) + H2(g)
I denne reaktion oxideres zinkmetal til dannelse af zinkioner (Zn2+), mens oxygen reduceres til dannelse af hydroxidioner (OH-). Zinkionerne reagerer derefter med hydroxidioner og danner zinkhydroxid, som er et hvidt, gelatineagtigt bundfald. Brintgassen, der produceres i reaktionen, frigives som bobler.
Korrosionshastigheden af zink afhænger af flere faktorer, herunder temperaturen, fugtigheden og tilstedeværelsen af andre kemikalier i miljøet. Generelt gælder det, at jo højere temperatur og luftfugtighed, jo hurtigere er korrosionshastigheden. Tilstedeværelsen af chloridioner (Cl-), såsom dem, der findes i havvand, kan også fremskynde korrosion af zink.
For at beskytte zink mod korrosion er det ofte belagt med et beskyttende lag maling eller anden tætningsmasse. Zink kan også legeres med andre metaller, såsom kobber eller aluminium, for at forbedre dets korrosionsbestandighed.
Sidste artikelMetaller, der findes i fast tilstand vinter og flydende sommer?
Næste artikelHvad er forbindelsen for zink og svovl?
 Varme artikler
Varme artikler
-
 Kollektiv adskillelse af sammenfiltrede polymererEt aktin filament i bevægelse. Kredit:C. Hohmann, NIM LMU-forskere har modbevist den konventionelle teori, der bruges til at forklare dynamikken i polymerløsninger. De viser, at for biopolymerer f
Kollektiv adskillelse af sammenfiltrede polymererEt aktin filament i bevægelse. Kredit:C. Hohmann, NIM LMU-forskere har modbevist den konventionelle teori, der bruges til at forklare dynamikken i polymerløsninger. De viser, at for biopolymerer f -
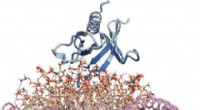 Indsigt på atomniveau opnået for et vigtigt lipidbindende protein impliceret i kræftNanodisk erstatning cellemembran:Protein er blåt, lipider er hvede, og de to spiralformede lipoproteiner, der holder lipid-nanoskiven sammen, er lyserøde. Kredit:Sanford Burnham Prebys Medical Discove
Indsigt på atomniveau opnået for et vigtigt lipidbindende protein impliceret i kræftNanodisk erstatning cellemembran:Protein er blåt, lipider er hvede, og de to spiralformede lipoproteiner, der holder lipid-nanoskiven sammen, er lyserøde. Kredit:Sanford Burnham Prebys Medical Discove -
 Team opdager dobbelt helixstruktur i syntetisk makromolekyleLou Madsen (tv.) er lektor i Kemisk Institut og har ledet et internationalt tværfagligt samarbejde om opdagelsen af den dobbelte helixstruktur af en polymer kaldet PBDT. Ying Wang (th.) er en tidlig
Team opdager dobbelt helixstruktur i syntetisk makromolekyleLou Madsen (tv.) er lektor i Kemisk Institut og har ledet et internationalt tværfagligt samarbejde om opdagelsen af den dobbelte helixstruktur af en polymer kaldet PBDT. Ying Wang (th.) er en tidlig -
 Ny algoritme hjælper med at afdække glemte figurer under Da Vinci-malerietKredit:Imperial College London Imperial- og National Gallery-forskere har brugt en ny algoritme til at hjælpe med at visualisere skjulte tegninger under Leonardo Da Vincis Virgin of the Rocks. Im
Ny algoritme hjælper med at afdække glemte figurer under Da Vinci-malerietKredit:Imperial College London Imperial- og National Gallery-forskere har brugt en ny algoritme til at hjælpe med at visualisere skjulte tegninger under Leonardo Da Vincis Virgin of the Rocks. Im
- Forskerhold undersøger de larvelignende bakterier, der kravler i vores mund
- Sådan skrives en laboratorieprocedure ved hjælp af flowdiagrammetode
- Debatter om campussikkerhed som reaktion på palæstinensisk solidaritetsaktivisme viser, at vi har …
- Mærkelig opdagelse kan hjælpe med at forfine teorier om, hvordan planeter dannes
- Forskere forudsiger rullende bevægelse med stor amplitude til sikrere hav
- Hvordan kontrollerer jeg Millivolts på et termoelement?


