Indsigt på atomniveau opnået for et vigtigt lipidbindende protein impliceret i kræft
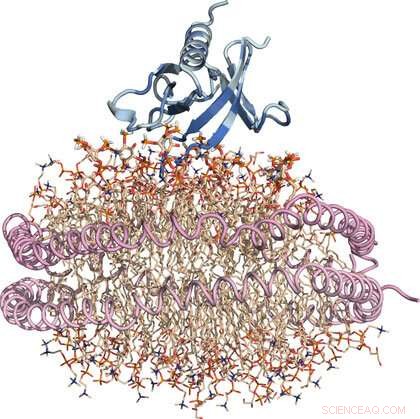
Nanodisk 'erstatning' cellemembran:Protein er blåt, lipider er hvede, og de to spiralformede lipoproteiner, der holder lipid-nanoskiven sammen, er lyserøde. Kredit:Sanford Burnham Prebys Medical Discovery Institute
Forskere ved Sanford Burnham Prebys har identificeret, på atomniveau, hvordan en del af et protein kaldet PLEKHA7 interagerer med en celles membran for at regulere vigtig intercellulær kommunikation.
Forskningen, offentliggjort i tidsskriftet Struktur , peger på hotspots inden for PLEKHA7 som mål for narkotika. Disse mål kan være nøglen til at designe behandlinger til avanceret tyktarm, bryst- og æggestokkræft.
Regionen, eller domæne, i PLEKHA7, som forskerne undersøgte, pleckstrin homologi (PH), findes almindeligvis i proteiner, der regulerer bevægelsen af celler såvel som andre vigtige cellulære aktiviteter. Hvis interaktionen mellem PH-domænet og lipiderne, der omfatter cellemembraner, forstyrres, sygdomme som kræft kan forekomme.
"PH-domæner er blevet undersøgt i nogen tid, men at undersøge deres interaktioner med membranassocierede lipider har været udfordrende, " siger Francesca M. Marassi, Ph.D., professor og direktør for Cell and Molecular Biology of Cancer Program ved Sanford Burnham Prebys og tilsvarende forfatter til undersøgelsen. "Vi optimerede vores strukturelle undersøgelser ved at bruge en kunstig membranskive, der er flere nanometer i størrelse. Denne nanodisk er en 'erstatnings' cellemembran og har været et vigtigt værktøj til at overvinde forhindringer i at studere strukturelle aspekter af fedtgrænseflader, såsom dem, der involverer lipider."
Efterforskerne brugte flere teknikker til at detaljere de præcise områder, hvor PH-domænet interagerede med lipider i en celles membran. Hver af de tre teknikker var lige vigtige:Røntgenkrystallografi gav et øjebliksbillede af strukturen; magnetisk resonans viste den præcise association af PH-domænet med lipidmembranoverfladen; og computersimuleringer sætter al denne information sammen for at generere en dynamisk film af interaktionen.
"Vi var i stand til at bestemme, at PH -domænet interagerer med cellemembranen flere steder samtidigt, derved demonstrerer membranens nøglerolle som en platform til at styre cellesignalering og adhæsion, " siger Marassi. "Vi fandt mindst tre steder langs PH-domænet, der er involveret i binding af lipider. At have flere websteder er afgørende, fordi hvis du tænker på PH -bindingsstederne som en lynlås mellem proteiner og lipider, hvert ekstra hak, der er grebet ind af en lynlås, gør bindingen stærkere og mere modstandsdygtig over for at blive trukket fra hinanden."
En af grundene til, at forskerne var interesserede i at udforske PLEKHA7, var, at proteinet for nylig er blevet identificeret som et potentielt anti-cancer-mål. Imidlertid, dens molekylære virkningsmekanisme har været usikker. Derudover forskerne var interesserede i PH-domænet, fordi det har været impliceret i avanceret bryst, nyre- og ovariecancer og mest fremtrædende, spiller en vigtig rolle i tyktarmskræft.
"Klinikere har vist, at PLEKHA7 er forhøjet hos patienter med tyktarmskræft, og dens niveauer stiger, når sygdommen forværres. Det er også blevet vist, at inhibering af PLEKHA7 nedsætter cellulær proliferation og migration, " siger Marassi. "Derfor, PLEKHA7 PH-domænet kan være et nyttigt lægemiddelmål, men der er behov for mere arbejde for at udvikle midler med større styrke og optimerede farmakologiske egenskaber."
Som et næste skridt, forskerne håber at dele deres strukturelle billeder med kolleger i andre laboratorier på Sanford Burnham Prebys, og andre steder, at screene for lægemidler, der er målrettet mod PH-domænet og lipidmembranbindingssteder.
 Varme artikler
Varme artikler
-
 Stort skridt i at producere kulstofneutralt brændstof:sølvdiphosphidKredit:CC0 Public Domain En ny kemisk proces beskrevet i tidsskriftet Naturkommunikation gør i laboratoriet, hvad træer gør i naturen - det omdanner kuldioxid til brugbare kemikalier eller brænd
Stort skridt i at producere kulstofneutralt brændstof:sølvdiphosphidKredit:CC0 Public Domain En ny kemisk proces beskrevet i tidsskriftet Naturkommunikation gør i laboratoriet, hvad træer gør i naturen - det omdanner kuldioxid til brugbare kemikalier eller brænd -
 Enheden binder metal og plastik på få sekunderSammenføjningspistolen binder metal og plastik på få sekunder og kan monteres på en robotarm i stedet for en punktsvejsepistol, for eksempel. Kredit:Fraunhofer IWS Forskere ved Fraunhofer Institut
Enheden binder metal og plastik på få sekunderSammenføjningspistolen binder metal og plastik på få sekunder og kan monteres på en robotarm i stedet for en punktsvejsepistol, for eksempel. Kredit:Fraunhofer IWS Forskere ved Fraunhofer Institut -
 Ny genetisk metode forbedrer enzymets effektivitetGregg Beckham (til venstre), Christopher Johnson, og Jeffery Linger er medforfattere af en ny forskerartikel, der beskriver, hvordan de forbedrede effektiviteten af et enzym ved nedbrydning af bioma
Ny genetisk metode forbedrer enzymets effektivitetGregg Beckham (til venstre), Christopher Johnson, og Jeffery Linger er medforfattere af en ny forskerartikel, der beskriver, hvordan de forbedrede effektiviteten af et enzym ved nedbrydning af bioma -
 Forskere opdager, at tung elementkemi kan ændre sig ved højt trykCurium krystaller med en orange glød, som forskerne brugte til at overvåge ændringerne i kemien, mens de påførte pres. Kredit:Thomas Albrecht-Schmitt / Nature Ny forskning viser, at et af de tunge
Forskere opdager, at tung elementkemi kan ændre sig ved højt trykCurium krystaller med en orange glød, som forskerne brugte til at overvåge ændringerne i kemien, mens de påførte pres. Kredit:Thomas Albrecht-Schmitt / Nature Ny forskning viser, at et af de tunge
- Hvordan vil klimaændringer påvirke kystsamfund? En undersøgelse af Virginias barriereøer
- Det er gratis og let at se tv med Locast under radaren
- Engang konger af tv, Amerikanske radio- og tv-netværk står over for regning
- Meta-linser bringer ydeevne på bordpladen til små, håndholdt spektrometer
- Ekstremt stærk nano-twinned ren nikkel med ekstrem fin tvillingtykkelse
- Forskere viser, at voksende atomtynde plader på kegler tillader kontrol af defekter


