Hvad er molaliteten af en opløsning bestående af 38,0 g rørsukker (C12H 22O11) opløst i 175 vand?
For at beregne molaliteten af opløsningen skal vi først bestemme antallet af mol opløst stof. Den molære masse af rørsukker er 342,3 g/mol, så antallet af mol rørsukker i 38,0 g er:
$$38,0 \text{ g rørsukker} \times \frac{1 \text{ mol rørsukker}}{342.3 \text{ g rørsukker}} =0,111 \text{ mol rørsukker}$$
Dernæst skal vi bestemme massen af opløsningsmidlet i kilogram. Vandets masse er 175 g, hvilket svarer til 0,175 kg.
Endelig kan vi beregne molaliteten af opløsningen ved at dividere antallet af mol opløst stof med massen af opløsningsmidlet i kilogram:
$$\text{Molalitet} =\frac{0,111 \text{ mol rørsukker}}{0,175 \text{ kg vand}} =0,634 \text{ mol/kg}$$
Derfor er opløsningens molalitet 0,634 mol/kg.
 Varme artikler
Varme artikler
-
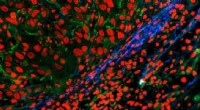 Oplyser vævsdannelse gennem flourescensBillede af tumorgrænse taget ved hjælp af fluorescensmikroskopi. Det nye markørmolekyle viser grænsen for tumoren i blåt; tumorvævet kan ses over det til venstre. Grøn:kollagen, rød:cellekerner. Kredi
Oplyser vævsdannelse gennem flourescensBillede af tumorgrænse taget ved hjælp af fluorescensmikroskopi. Det nye markørmolekyle viser grænsen for tumoren i blåt; tumorvævet kan ses over det til venstre. Grøn:kollagen, rød:cellekerner. Kredi -
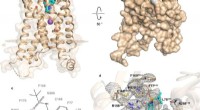 Undersøgelse afslører strukturen af receptor impliceret i type 2 -diabetes og mereFig. 1:Struktur og bindingssted for hBLT1. Kredit:Michaelian, N., et al. Naturkommunikation , https://doi.org/10.1038/s41467-021-23149-1 Forskere fra University of Southern California, Merck &Co
Undersøgelse afslører strukturen af receptor impliceret i type 2 -diabetes og mereFig. 1:Struktur og bindingssted for hBLT1. Kredit:Michaelian, N., et al. Naturkommunikation , https://doi.org/10.1038/s41467-021-23149-1 Forskere fra University of Southern California, Merck &Co -
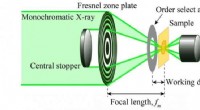 Et scanningstransmission røntgenmikroskop til analyse af kemiske tilstande af lithiumSkematisk af et optisk system af et blødt røntgenmikroskop (STXM) med scannetransmission. Kredit:NINS/IMS Lithium-ion-batterier (LIB) er meget brugt til daglige produkter i vores liv, såsom hybrid
Et scanningstransmission røntgenmikroskop til analyse af kemiske tilstande af lithiumSkematisk af et optisk system af et blødt røntgenmikroskop (STXM) med scannetransmission. Kredit:NINS/IMS Lithium-ion-batterier (LIB) er meget brugt til daglige produkter i vores liv, såsom hybrid -
 Teoretisk forudsigelse af omvendt intersystemkrydsning for organiske halvledereKredit:CC0 Public Domain Et fælles forskerhold ved RIKEN og Hokkaido University udviklede en metode til at forudsige hastighedskonstanter for reverse intersystem crossing (RISC) forbundet med lyse
Teoretisk forudsigelse af omvendt intersystemkrydsning for organiske halvledereKredit:CC0 Public Domain Et fælles forskerhold ved RIKEN og Hokkaido University udviklede en metode til at forudsige hastighedskonstanter for reverse intersystem crossing (RISC) forbundet med lyse
- Sprint, T-Mobile-fusion får første grønt lys
- Hvordan påvirker landbruget sårbare insektædende fugle?
- Volkswagen lover at bygge 22 millioner e-biler i løbet af det næste årti
- Forskere foreslår en metode til at balancere brugeroplevelse og skyomkostninger
- Forskere opretter den første lavenergipartikelacceleratorstråle under jorden i USA
- Ny indsigt i, hvordan celleform påvirker proteintransporthastigheder


