Undersøgelse afslører strukturen af receptor impliceret i type 2 -diabetes og mere
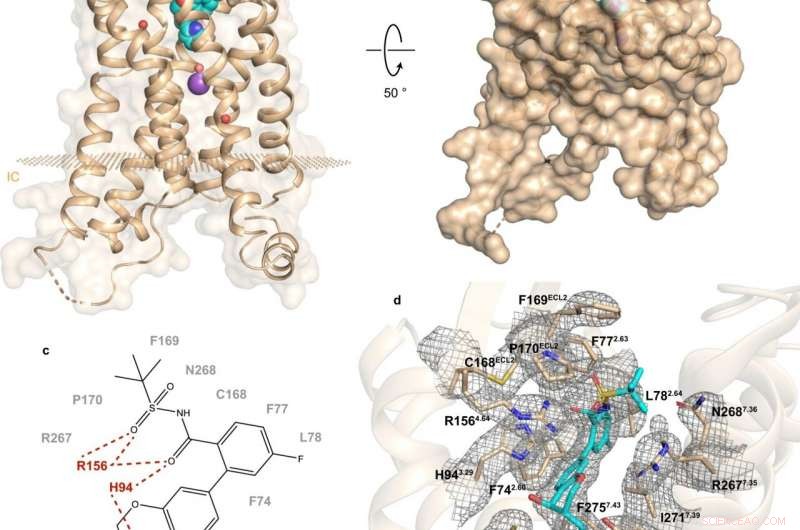
Fig. 1:Struktur og bindingssted for hBLT1. Kredit:Michaelian, N., et al. Naturkommunikation , https://doi.org/10.1038/s41467-021-23149-1
Forskere fra University of Southern California, Merck &Co., Skoltech, MIPT, UCLA, og Université de Sherbrooke har bestemt strukturen af den humane leukotrien B4 -receptor 1, involveret i inflammatorisk, smitsom, allergisk, og tumorigene sygdomme. Udgivet i Naturkommunikation , analysen af strukturen afslører, hvordan receptoren genkender sine bindingspartnere og interagerer med dem. Dette åbner muligheder for at designe bedre lægemidler, der er målrettet mod receptoren til behandling af type 2 -diabetes og andre patologier.
Receptorer er det proteinbaserede udstyr, cellerne bruger til at modtage og transmittere signaler. En receptor aktiveres, når den binder et messengermolekyle kaldet en agonist, hvorefter det videresender signalet, som regulerer en vis biologisk funktion. Antagonister, derimod, luk receptoren, når den er bundet. Agonister og antagonister er samlet kendt som ligander.
Den humane leukotrien B4 -receptor 1, eller hBLT1, regulerer inflammationsrelaterede processer-såsom rekruttering af T-celler-samt spredning og migration af glatte muskelceller. Denne receptor har været forbundet med sygdomme, herunder astma, influenza, gigt, åreforkalkning, diabetes, og kræft.
Siden opdagelsen i 1997, der har været en række forsøg på at udvikle hBLT1 -ligander til brug som lægemidler, men de havde mange bivirkninger, lav effektivitet, og kroppen tog forholdsvis lang tid at eliminere dem. En sandsynlig forklaring på dette er, at de anvendte hBLT1 -ligander ikke er specifikke for den pågældende receptor og deltager i andre uønskede interaktioner. At lære mere om receptorens struktur og hvordan den binder ligander kan give farmakologer mulighed for at designe bedre, mere selektive lægemidler.
En nylig undersøgelse foretaget af et russisk-amerikansk-canadisk samarbejde belyser sammensætningen og funktionen af hBLT1. Vadim Cherezov, professor i kemi ved USC og leder af MIPT Laboratory for Structural Biology of GPCRs, kommenterede:"Vi har bestemt 2,9-Ångstrøm-opløsning krystalstrukturen af hBLT1-receptoren i kompleks med en selektiv antagonist, MK-D-046, udviklet af Merck &Co.
Strukturbestemmelse blev suppleret med stedstyret mutagenese og dockingstudier-en eksperimentel og en beregningsmetode, henholdsvis. Ifølge Skoltech -adjunkt Petr Popov, "dette gjorde det muligt at afsløre de vigtigste determinanter for intermolekylære interaktioner mellem receptoren og liganderne."
Analysen af hBLT1 -struktur afslører, hvordan receptoren genkender og binder ligander, hvilket tyder på en formodet ligandadgangskanal begravet i receptorens membran. Mere specifikt, fundene antyder de mulige måder, receptoren kan binde sine endogene agonister på. Det er, forbindelser naturligt produceret af kroppen til at binde sig til den receptor og aktivere den.
Ved at forbedre vores forståelse af hBLT1 -struktur og funktion, undersøgelsen åbner muligheder for strukturbaseret lægemiddeldesign.
 Varme artikler
Varme artikler
-
 Ny teknologi til fremstilling af porøst aluminiumDen nye teknologi til fremstilling af usænkeligt materiale fra aluminiumslegeringen blev patenteret ved Peter the Great St. Petersburg Polytechnic University (SPbPU). Kredit:Peter den Store St. Peters
Ny teknologi til fremstilling af porøst aluminiumDen nye teknologi til fremstilling af usænkeligt materiale fra aluminiumslegeringen blev patenteret ved Peter the Great St. Petersburg Polytechnic University (SPbPU). Kredit:Peter den Store St. Peters -
 Hvorfor fotosyntese virker bedre for nogle planter end andreFigur 1:Opladningsfordeling på aktive steder og CO2 -genkendelsesevne for forskellige typer RuBisCO. S rel i grafen viser værdien, der angiver CO2 -genkendelsesevnen for hver RuBisCO. Jo højere værdi,
Hvorfor fotosyntese virker bedre for nogle planter end andreFigur 1:Opladningsfordeling på aktive steder og CO2 -genkendelsesevne for forskellige typer RuBisCO. S rel i grafen viser værdien, der angiver CO2 -genkendelsesevnen for hver RuBisCO. Jo højere værdi, -
 Studerer mekanismen for metalekstraktion med ioniske væskerOpløsning af ionisk flydende betainium -bis (trifluormethylsulfonyl) imid i den vandige fase starter kemiske interaktioner og fordeling af ioner mellem de to flydende faser. Kredit:J. Mol et al., Virk
Studerer mekanismen for metalekstraktion med ioniske væskerOpløsning af ionisk flydende betainium -bis (trifluormethylsulfonyl) imid i den vandige fase starter kemiske interaktioner og fordeling af ioner mellem de to flydende faser. Kredit:J. Mol et al., Virk -
 Sådan identificeres, om en opløsning er neutral, base eller syreEn almindelig opgave i kemi-laboratorier er at identificere, om en given opløsning er sur, neutral eller basisk, som bestemmes af en opløsnings pH-niveau. Afhængigt af dit laboratoriums udstyr og hvil
Sådan identificeres, om en opløsning er neutral, base eller syreEn almindelig opgave i kemi-laboratorier er at identificere, om en given opløsning er sur, neutral eller basisk, som bestemmes af en opløsnings pH-niveau. Afhængigt af dit laboratoriums udstyr og hvil
- NASA følger Tropical Storm Nuris-stien
- To vitale buffere mod klimaændringer er lige offshore
- Murdochs 21st Century Fox øger Skys bud på at slå rivalen Comcast
- Hjernevask-myten
- En ny måde at levere lægemidler med præcis målretning
- Gestik hjælper eleverne med at lære nye ord på forskellige sprog, undersøgelse finder


