Hvad er kogepunktet for 1 molær urinstofopløsning?
$$\Delta T_b =K_b \cdot m$$
hvor $\Delta T_b$ er kogepunktshøjden, $K_b$ er opløsningsmidlets kogepunktshøjdekonstant, og $m$ er opløsningens molalitet.
For vand er $K_b$ 0,512 °C/m. Molaliteten af en 1 molær urinstofopløsning er:
$$m =\frac{1 \text{ mol urea}}{1 \text{ kg vand}} =1 \text{ mol/kg}$$
Derfor er kogepunktsstigningen for en 1 molær urinstofopløsning:
$$\Delta T_b =0,512 °C/m \cdot 1 \text{ mol/kg} =0,512 °C$$
Kogepunktet for en 1 molær urinstofopløsning er derfor:
$$T_b =100 °C + 0,512 °C =100,512 °C$$
Sidste artikelHvordan beregner man 250 ppm kloropløsning i vand?
Næste artikelHvad er transparent i spektrometriske termer?
 Varme artikler
Varme artikler
-
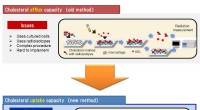 En ny praktisk test for funktionen af HDL, bæreren af det gode kolesterolKolesteroludstrømningskapacitet og optagelseskapacitet er vist. Kredit:Kobe University High-density lipoprotein kolesterol (HDL-C) er kendt som godt kolesterol, fordi HDL-partikler fjerner oversky
En ny praktisk test for funktionen af HDL, bæreren af det gode kolesterolKolesteroludstrømningskapacitet og optagelseskapacitet er vist. Kredit:Kobe University High-density lipoprotein kolesterol (HDL-C) er kendt som godt kolesterol, fordi HDL-partikler fjerner oversky -
 Ny undersøgelse ser på biologiske enzymer som kilde til brintbrændstofKemiprofessor Thomas Rauchfuss og samarbejdspartnere søger biologiske processer for at finde en effektiv kilde til brintgas som et miljøvenligt brændstof. Kredit:Fred Zwicky Forskning fra Universi
Ny undersøgelse ser på biologiske enzymer som kilde til brintbrændstofKemiprofessor Thomas Rauchfuss og samarbejdspartnere søger biologiske processer for at finde en effektiv kilde til brintgas som et miljøvenligt brændstof. Kredit:Fred Zwicky Forskning fra Universi -
 Materialebehandlingstricks gør det muligt for ingeniører at skabe nyt lasermaterialeVed at dope aluminiumoxidkrystaller med neodymioner, ingeniører ved University of California San Diego har udviklet et nyt lasermateriale, der er i stand til at udsende ultrakort, højeffektimpulser-en
Materialebehandlingstricks gør det muligt for ingeniører at skabe nyt lasermaterialeVed at dope aluminiumoxidkrystaller med neodymioner, ingeniører ved University of California San Diego har udviklet et nyt lasermateriale, der er i stand til at udsende ultrakort, højeffektimpulser-en -
 Bindingsdissociationsenergier for overgangsmetalsilicider er nøjagtigt bestemtKredit:CC0 Public Domain Overgangsmetal silicider, en særskilt klasse af halvledende materialer, der indeholder silicium, demonstrere overlegen oxidationsmodstand, høj temperaturstabilitet og lave
Bindingsdissociationsenergier for overgangsmetalsilicider er nøjagtigt bestemtKredit:CC0 Public Domain Overgangsmetal silicider, en særskilt klasse af halvledende materialer, der indeholder silicium, demonstrere overlegen oxidationsmodstand, høj temperaturstabilitet og lave
- Kæledyr eller trusler? Guldfisk kan være skadelig for biodiversiteten
- Hæmmer eller fremmer zink vækst af nyresten? Godt, begge
- NASAs Operation IceBridge afslutter 11 års polarundersøgelser
- Sådan fungerer hydrauliske kraner
- Halvledende nanonetværk kan danne rygraden i gennemsigtige, fleksibel elektronik
- To nye opdagelser kaster lys over mysteriet om, hvordan celler håndterer stress


