Hvad får kobbersulfat til at være blåt?
Farven på en forbindelse bestemmes af den måde, hvorpå dens elektroner interagerer med lys. Når lys rammer en forbindelse, absorberes noget af lysenergien af elektronerne, og resten reflekteres. Sammensætningens farve afhænger af lysets bølgelængder, der reflekteres.
I tilfælde af kobbersulfat har kobber(II)-ionen en ufuldstændig d-elektronskal. Det betyder, at der er nogle elektroner i d-orbitalerne, som ikke er parret. Når lys rammer kobbersulfatforbindelsen, kan disse uparrede elektroner absorbere energi fra lyset og blive ophidsede. Den energi, der absorberes, svarer til bølgelængden af lys i det blå område af det synlige spektrum. De andre bølgelængder af lys reflekteres, hvorfor kobbersulfat fremstår blåt.
Farven på en forbindelse kan også påvirkes af tilstedeværelsen af andre ioner eller molekyler. For eksempel, hvis en lille mængde ammoniak tilsættes til en kobbersulfatopløsning, vil opløsningen få en dyb blå farve. Dette skyldes, at ammoniakmolekylerne reagerer med kobber(II)-ionerne og danner en kompleks ion kaldet kobber(II)-tetraammin. Denne komplekse ion har en anden elektronisk struktur end kobber(II)-ionen, og den absorberer lys ved en anden bølgelængde. Det er grunden til, at løsningen får en dyb blå farve.
Sidste artikelHvad sker der, når jern og kobbersulfat reagerer?
Næste artikelHvad er bølgelængden for kobber ii sulfat?
 Varme artikler
Varme artikler
-
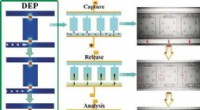 Mikrofluid chip til analyse af enkeltcellerKredit:Wiley Et par små celler, der er forskellige fra resten, kan have en stor effekt. For eksempel, enkelte kræftceller kan være resistente over for en bestemt kemoterapi - hvilket forårsager et
Mikrofluid chip til analyse af enkeltcellerKredit:Wiley Et par små celler, der er forskellige fra resten, kan have en stor effekt. For eksempel, enkelte kræftceller kan være resistente over for en bestemt kemoterapi - hvilket forårsager et -
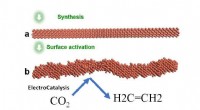 Forskere opdager en effektiv vej til at omdanne kuldioxid til ethylenIllustration af ElectroCatalysis-systemet, som syntetiserede den glatte nanotråd og derefter aktiverede den ved at påføre en spænding for at få den ru trinflade, der er meget selektiv for CO2-reduktio
Forskere opdager en effektiv vej til at omdanne kuldioxid til ethylenIllustration af ElectroCatalysis-systemet, som syntetiserede den glatte nanotråd og derefter aktiverede den ved at påføre en spænding for at få den ru trinflade, der er meget selektiv for CO2-reduktio -
 En molekylær køreplan til plantens immunsystemKredit:Unsplash/CC0 Public Domain De seneste fremskridt i vores forståelse af plantens immunsystem er kortlagt i en ny anmeldelse af John Innes Center-forskere. En molekylær køreplan til plantens
En molekylær køreplan til plantens immunsystemKredit:Unsplash/CC0 Public Domain De seneste fremskridt i vores forståelse af plantens immunsystem er kortlagt i en ny anmeldelse af John Innes Center-forskere. En molekylær køreplan til plantens -
 Forskere opdager ny elektrokatalysator til at omdanne kuldioxid til flydende brændstofKunstnerisk gengivelse af elektrokatalytisk proces til omdannelse af kuldioxid og vand til ethanol. Kredit:Kredit:Argonne National Laboratory Katalysatorer fremskynder kemiske reaktioner og danner
Forskere opdager ny elektrokatalysator til at omdanne kuldioxid til flydende brændstofKunstnerisk gengivelse af elektrokatalytisk proces til omdannelse af kuldioxid og vand til ethanol. Kredit:Kredit:Argonne National Laboratory Katalysatorer fremskynder kemiske reaktioner og danner
- Facebooks administrerende direktør planlægger fora i 2019 om teknologiens rolle i samfundet
- En ny nærhedsmærkningsmetode i nanometerskala målrettet histidinrester
- Nyt design kan hjælpe med at kaste overskydende varme i næste generations fusionskraftværker
- Kystbyer efterlader op til 75 % af havbunden udsat for skadelig lysforurening
- Amazons kvartalsresultat raketter tidoblet til $2,9 mia
- Fleksibel isolator giver høj styrke og overlegen termisk ledning


