Hvad sker der, når jern og kobbersulfat reagerer?
Reaktionen kan repræsenteres ved følgende ligning:
```
Fe + CuSO4 -> FeSO4 + Cu
```
I denne ligning repræsenterer Fe jern, CuSO4 repræsenterer kobbersulfat, FeSO4 repræsenterer jernsulfat, og Cu repræsenterer kobbermetal.
Reaktionen vil opstå, når de to reaktanter er i kontakt med hinanden. Jernatomerne vil kollidere med kobbersulfatmolekylerne, og jernatomerne vil fortrænge kobberatomerne fra forbindelsen. Kobberatomerne vil derefter blive aflejret på overfladen af jernet.
Reaktionen vil fortsætte, indtil alle jernatomerne er blevet reageret. Mængden af kobber, der produceres, vil være lig med den mængde jern, der blev brugt.
Reaktionen mellem jern og kobbersulfat er et eksempel på en redoxreaktion. I en redoxreaktion oxideres et stof, og et andet stof reduceres. I dette tilfælde oxideres jernet, og kobberet reduceres.
Oxidationen af jern kan repræsenteres ved følgende ligning:
```
Fe -> Fe2+ + 2e-
```
I denne ligning repræsenterer Fe jern, Fe2+ repræsenterer jernholdigt jern, og e- repræsenterer en elektron.
Reduktionen af kobber kan repræsenteres ved følgende ligning:
```
Cu2+ + 2e- -> Cu
```
I denne ligning repræsenterer Cu2+ kobber, Cu repræsenterer kobbermetal, og e- repræsenterer en elektron.
Sidste artikelHvad er oxidationstallet for MN i 2MnO4-?
Næste artikelHvad får kobbersulfat til at være blåt?
 Varme artikler
Varme artikler
-
 Ensomme vandmolekyler viser sig at være direktører for supramolekylær kemiBert Meijer, professor i organisk kemi, og postdoktorforsker Nathan van Zee. Kredit:Bart van Overbeeke Forskere inden for supramolekylær kemi støder ofte på overraskende resultater. En brudt forse
Ensomme vandmolekyler viser sig at være direktører for supramolekylær kemiBert Meijer, professor i organisk kemi, og postdoktorforsker Nathan van Zee. Kredit:Bart van Overbeeke Forskere inden for supramolekylær kemi støder ofte på overraskende resultater. En brudt forse -
 Byggesæt til specialdesignede produkterFra venstre mod højre:Dr. Yan-Ni Shi, Prof. Helge Bode, Janik Kranz, Peter Grün og Andreas Tietze. Kredit:Jürgen Lecher, Goethe Universitet Mikroorganismer samler ofte naturlige produkter svarende
Byggesæt til specialdesignede produkterFra venstre mod højre:Dr. Yan-Ni Shi, Prof. Helge Bode, Janik Kranz, Peter Grün og Andreas Tietze. Kredit:Jürgen Lecher, Goethe Universitet Mikroorganismer samler ofte naturlige produkter svarende -
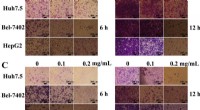 Marine bakterielt exopolysaccharid EPS11 hæmmer migration og invasion af levercancercellerFigur 1EPS11 hæmmer migration, invasion og kolonidannelse af levercancerceller (Huh7.5, Bel-7402, og HepG2 -cellelinjer). (A) Observation af fi liform-strukturer i Bel-7402 og HepG2-celler efter behand
Marine bakterielt exopolysaccharid EPS11 hæmmer migration og invasion af levercancercellerFigur 1EPS11 hæmmer migration, invasion og kolonidannelse af levercancerceller (Huh7.5, Bel-7402, og HepG2 -cellelinjer). (A) Observation af fi liform-strukturer i Bel-7402 og HepG2-celler efter behand -
 Bioinspirerede materialer-lån fra naturens legebogEt skibsskelet af havsvamp, der viser den komplekse karakter af dets struktur, som giver fantastisk styrke. Kredit:Michael Monn, Kesari Lab, Brown University Naturen giver utallige eksempler på un
Bioinspirerede materialer-lån fra naturens legebogEt skibsskelet af havsvamp, der viser den komplekse karakter af dets struktur, som giver fantastisk styrke. Kredit:Michael Monn, Kesari Lab, Brown University Naturen giver utallige eksempler på un
- Hvad vil rumfanget af 16,0 gram svovldioxidgas være ved 35 C og 97 ATM?
- Nye data viser spring i videnskab og ingeniøruddannelse
- Hvor mange hydrogener og oxygener har ribose?
- Sticky partikler lover mere præcis lægemiddellevering til hjernekræft
- NASAs nye lette røntgenspejle klar til afprøvning i rummet
- Bør vores største frygt for klimaændringer være sig selv?


